Efficacité
L’efficacité et la sécurité de WELIREG® ont été étudiées dans l’étude de phase 2 LITESPARK-004.1,2
Plan de l’étude2
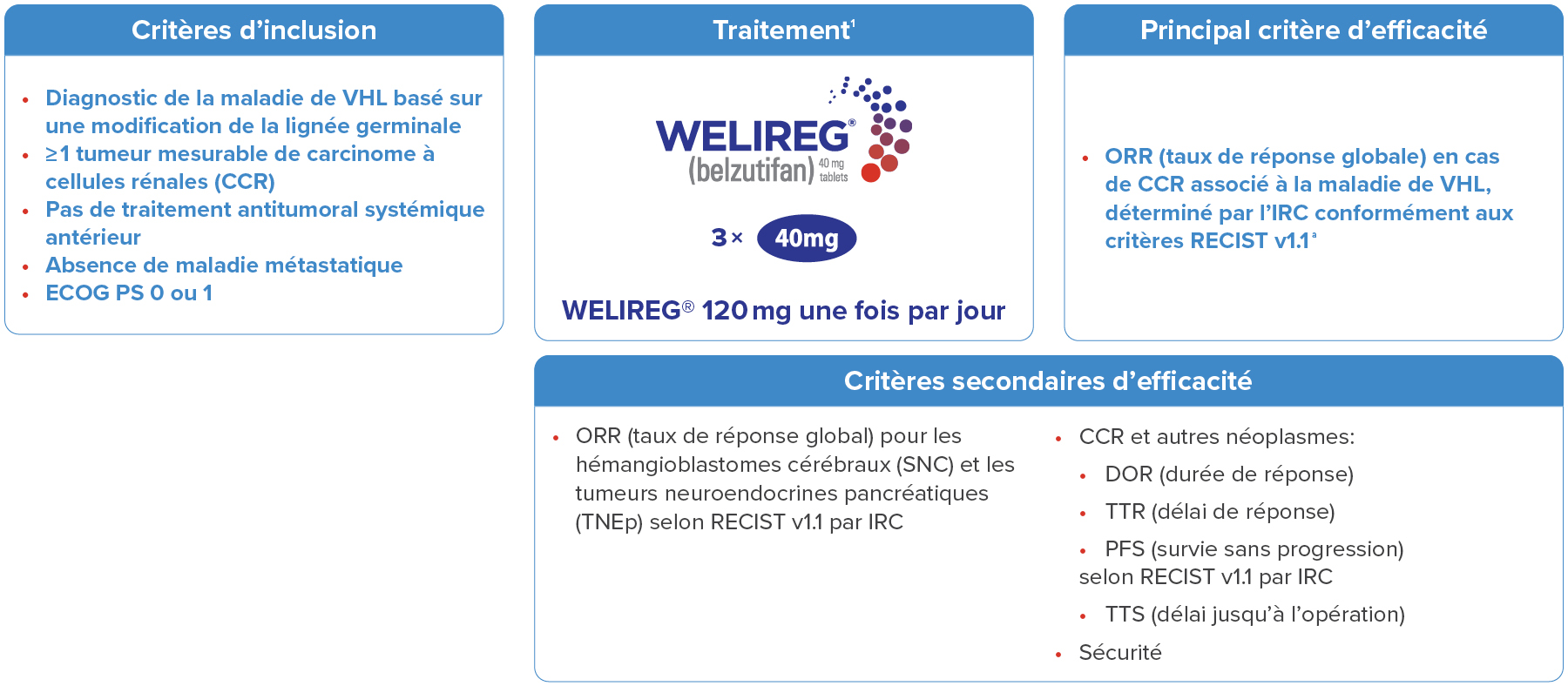
Adapté d’après l’information professionnelle de WELIREG®1 et Jonasch E, et al. , NEJM 2021.2
a. La réponse conformément aux critères RECIST v1.1 était définie comme suit: ≥ 30% de diminution de la somme des diamètres des lésions cibles (la référence étant la somme des diamètres au début de l’étude).1,3

Adapté d’après l’information professionnelle de WELIREG®1 et Jonasch E, et al. , NEJM 2021.2
Résultats à long terme de l’étude de phase 2 LITESPARK-004 avec un suivi médian de 49.9 (48.2 – 58.1) mois4
L’étude LITESPARK-004 a montré que WELIREG® avait un effet antitumoral durable sur les tumeurs associées à la maladie de VHL, avec un suivi médian de plus de 4 ans.4
- 75% (n = 46) des patient(e)s ont subi 86 procédures de réduction de la tumeur au cours des quatre années précédant le début du traitement. 26% (n = 16) des patient(e)s ont subi 18 procédures de réduction de tumeur après le début du traitement parWELIREG®.4
- 59% (n = 36) des patient(e)s étaient toujours sous traitement à la date butoir.4
- Le profil de sécurité est resté largement inchangé.4

Adapté d’après Srinivasan R., et al., AACR 2024.4
Durée médiane de suivi entre la première dose et la date butoir pour les données (3 avril 2023) : 49.9 mois (intervalles: 48.2-58.1).
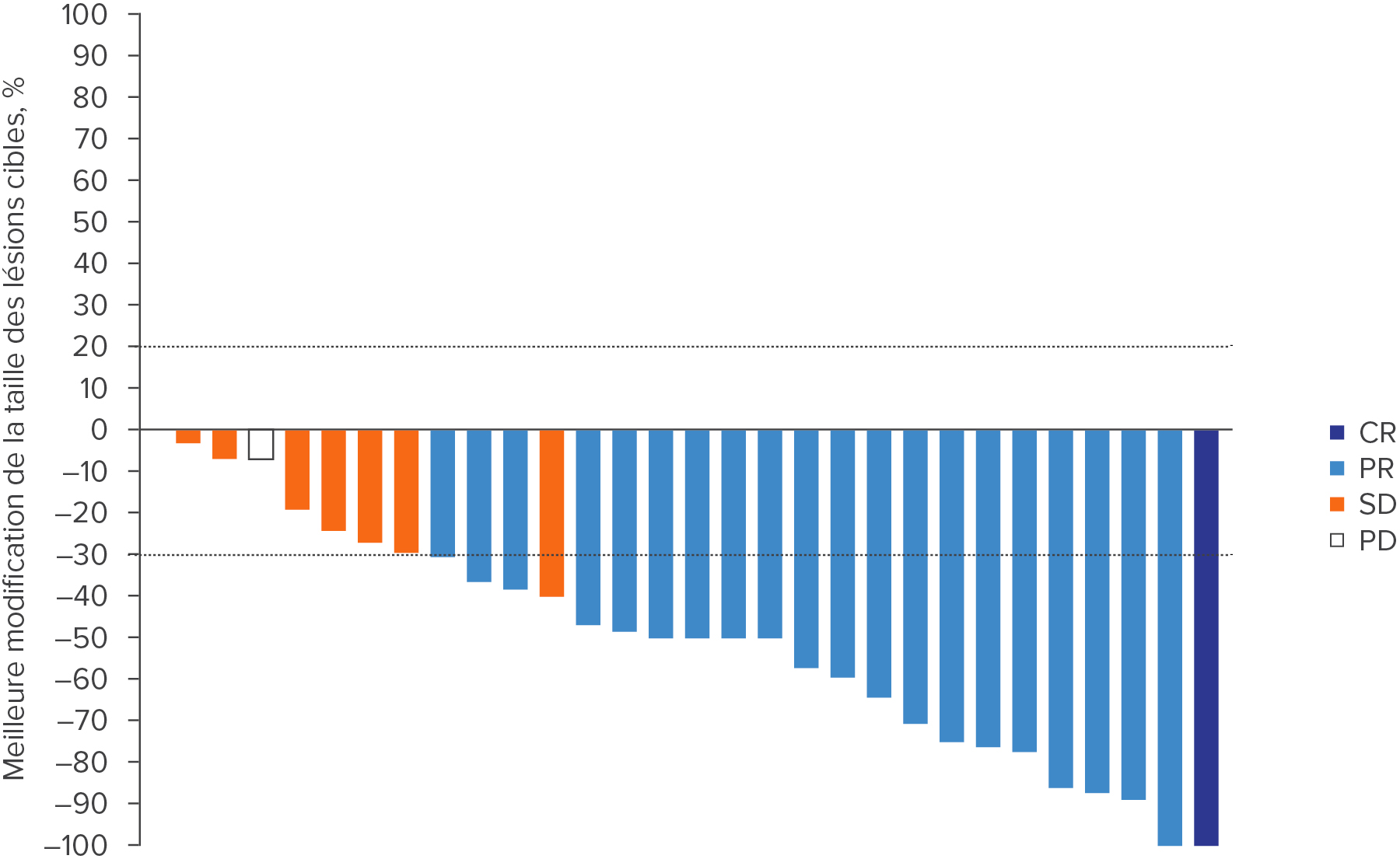
WELIREG® a permis de diminuer la taille des tumeurs en cas de CCR associé à la maladie de VHL4
Chez 41 patient(e) (67%), la taille des lésions cibles a diminué.4

Adapté d’après Srinivasan R., et al., AACR 2024.4
Durée du traitement par WELIREG® des lésions cibles du CCR associé à VHL, meilleur taux de réponse global et statut de progression de la maladie4

Adapté d’après Srinivasan R., et al., AACR 2024.4
Évaluation Kaplan-Meier de DOR et PFS dans le CCR associé à la maladie de VHL4,a
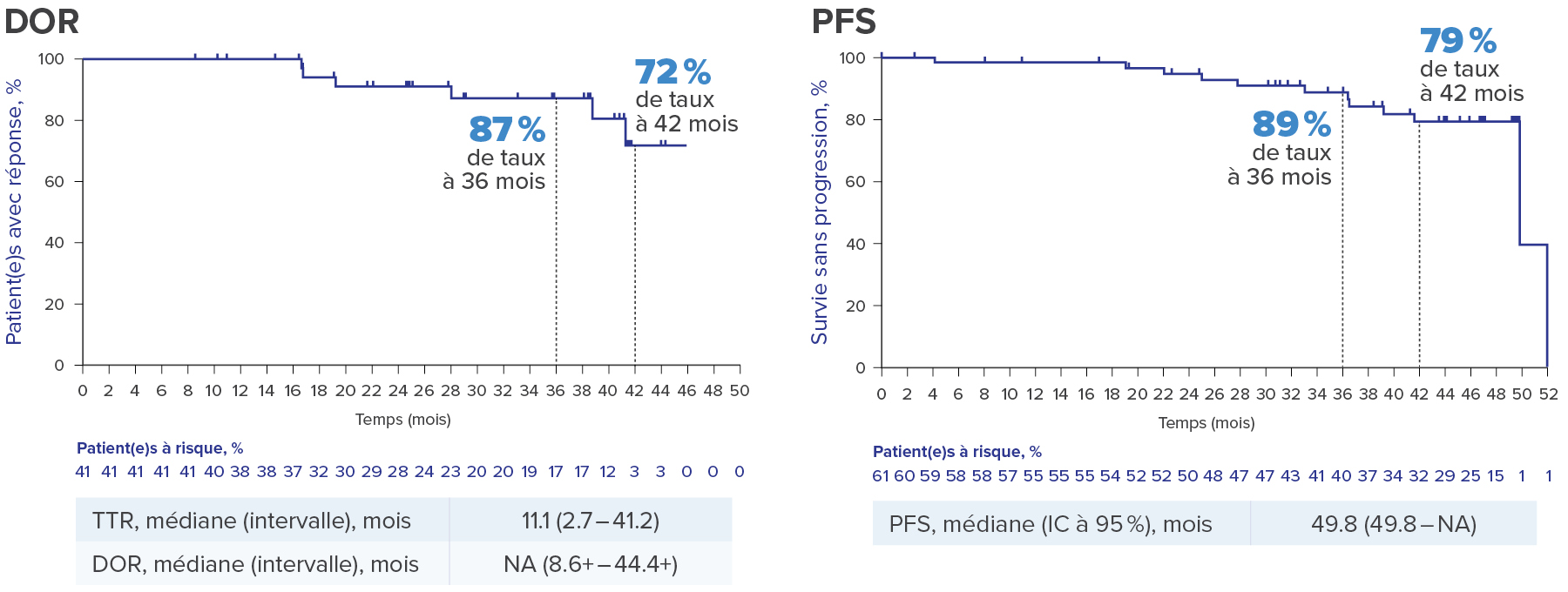
Graphiques adaptés d’après Srinivasan R., et al., AACR 2024.4
a. selon RECIST v1.1 par l’IRC.
+ indique que la réponse est toujours en cours.

Adapté d’après Srinivasan R., et al., AACR 2024.4
a. Données insuffisantes pour évaluer la réponse selon RECIST v1.1.
+ indique que la réponse est toujours en cours.
Durée médiane de suivi entre la première dose et la date butoir pour les données (3 avril 2023) : 49.9 mois (intervalles: 48.2-58.1).
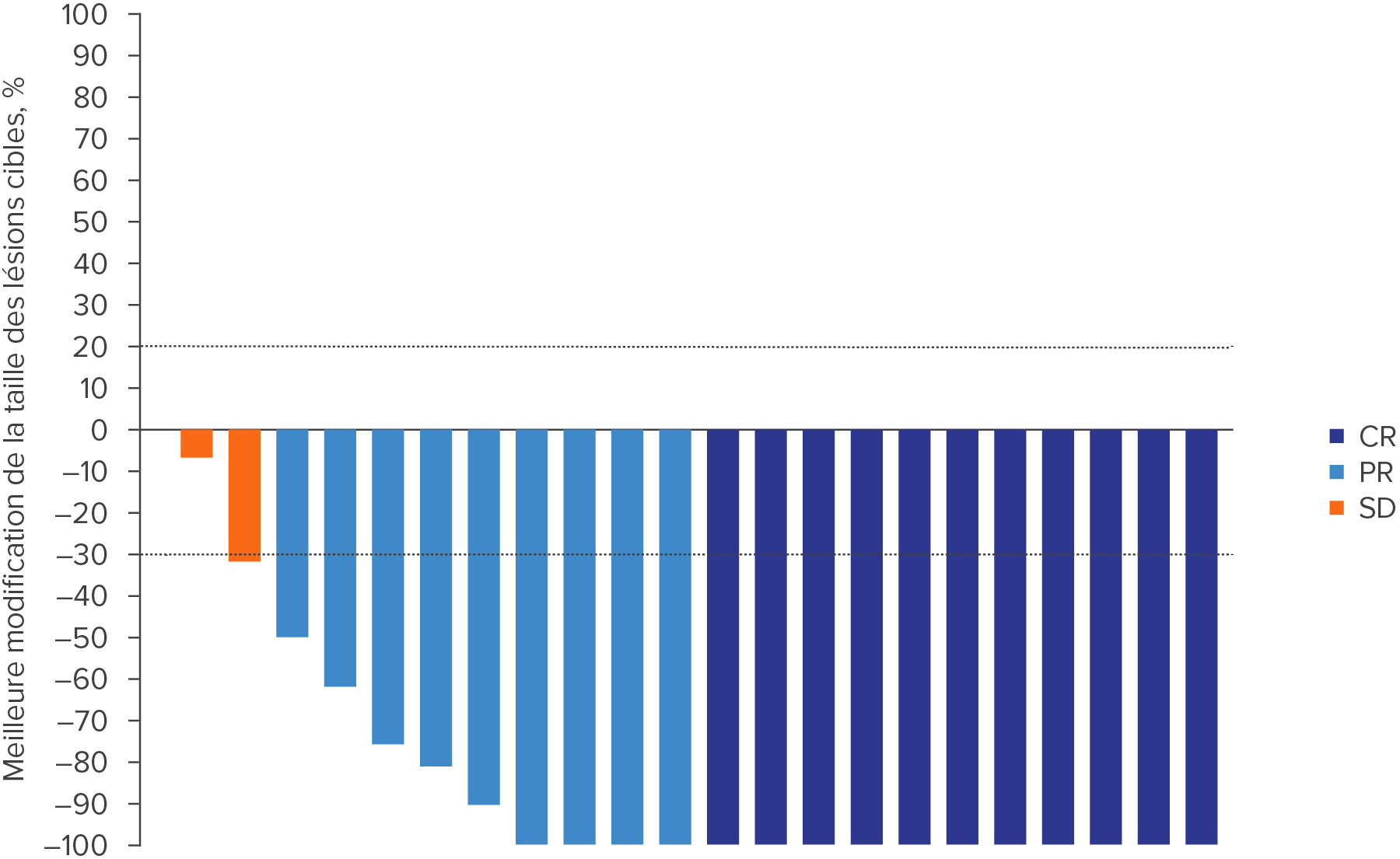
WELIREG® a permis de diminuer la taille des hémangioblastomes du SNC associés à la maladie de VHL4,a
Adapté d’après Srinivasan R., et al., AACR 2024.4
a. Des données évaluables après le début de l’étude avec une maladie mesurable étaient disponibles pour 30 des 50 patient(e)s; 4 patient(e)s ont obtenu une CR, dont 3 patient(e)s qui ne présentaient qu’une maladie non mesurable au début de l’étude, et 3 patient(e)s ont eu une PD, dont 2 qui ne présentaient qu’une maladie non mesurable au début de l’étude (non représenté(e)s dans le diagramme en cascade). Date butoir: 3 avril 2023.4

Adapté d’après Srinivasan R., et al., AACR 2024.4
a. Données insuffisantes pour évaluer la réponse selon RECIST v1.1.
b. Les données concernent toutes les lésions pancréatiques (n = 61), y compris les lésions TNEp et non TNEp.
+ indique que la réponse est toujours en cours.
Durée médiane de suivi entre la première dose et la date butoir pour les données (3 avril 2023) : 49.9 mois (intervalles: 48.2-58.1).
WELIREG® a permis de réduire la taille des TNEp associées à la maladie de VHL4
Adapté d’après Srinivasan R., et al., AACR 2024.4
WELIREG® a permis de diminuer le nombre d’opérations liées à la maladie de VHL.4
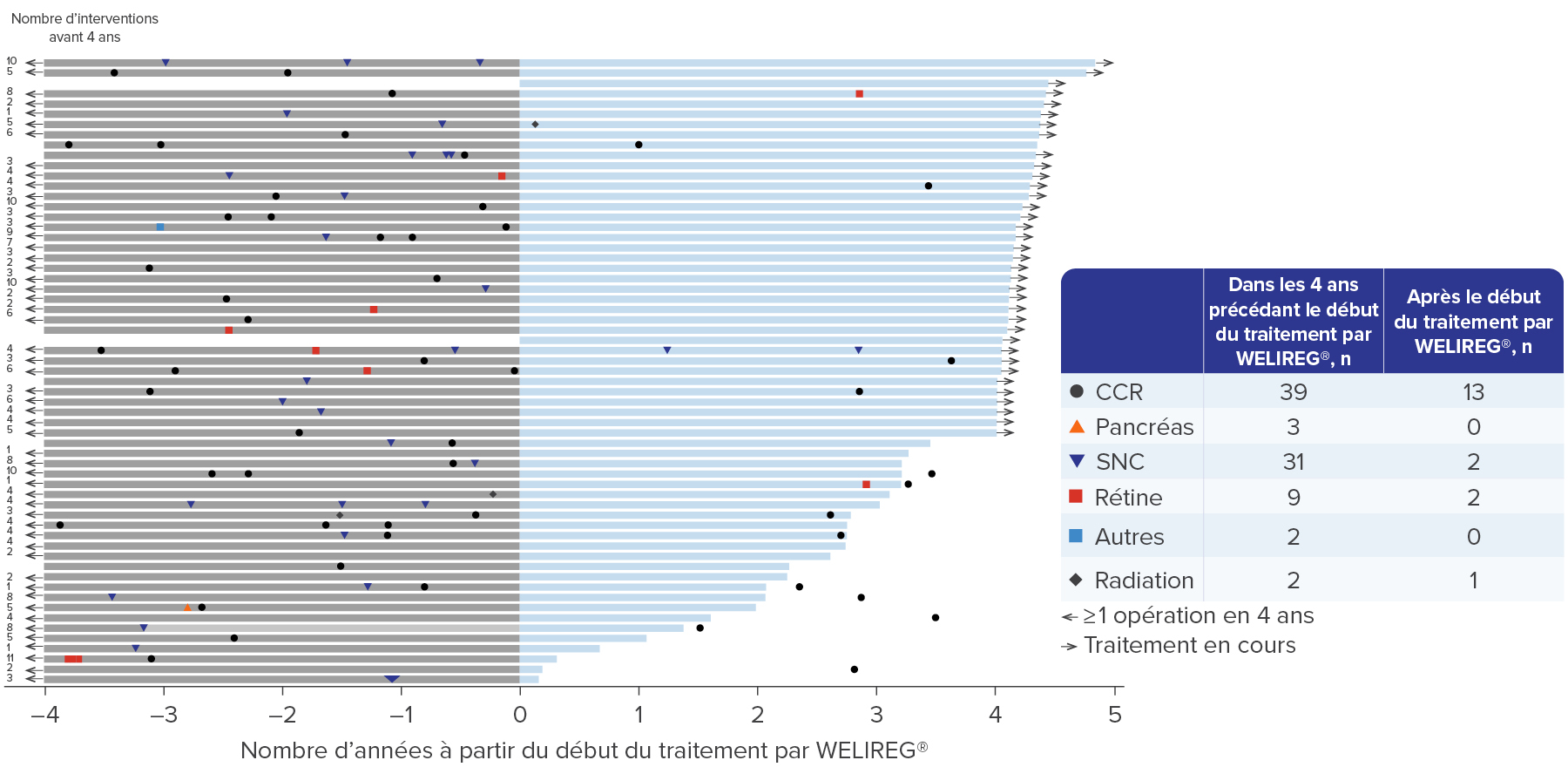
Adapté d’après Srinivasan R., et al., AACR 2024.4
Les résultats à long terme de l’étude LITESPARK-004 (analyse de suivi à 49.9 (48.2 – 58.1) mois) continuent de soutenir l’efficacité de WELIREG® pour le CCR associé à la maladie de VHL, les hémangioblastomes du SNC et les TNEp.4
Abréviations:
CCR: carcinome à cellules rénales; CR: réponse complète (complete response); DOR: durée de réponse (duration of response); ECOG PS: Eastern Cooperative Oncology Group performance status; IRC: comité d’évaluation indépendant (independent review committee); ORR: taux de réponse globale (overall response rate); PD: maladie progressive (progressive disease); PR: réponse partielle (partial response); RECIST v1.1: Response Evaluation Criteria In Solid Tumors v1.1; SD: maladie stable (stable disease); SNC: système nerveux central; TNEp: tumeurs neuroendocrines du pancréas; TTR: délai de réponse (time to response); TTS: délai jusqu’à l’opération (time to surgery); VHL: Von-Hippel-Lindau.
Références:
- Information professionnelle de WELIREG® (Belzutifan), www.swissmedicinfo.ch, dernière consultation le 07.03.2025.
- Jonasch E, et al. Belzutifan for Renal Cell Carcinoma in von Hippel-Lindau Disease. N Engl J Med. 2021;385:2036 – 2046. DOI: 10.1056/NEJMoa2103425.
- Eisenhauer EA, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228 – 247.
- Srinivasan R, et al. Belzutifan, a Hypoxia-Inducible Factor-2α Inhibitor, for von Hippel-Lindau Disease–Associated Neoplasms: Long-Term Results of the Phase 2 LITESPARK-004 Study. Presented at the American Association for Cancer Research (AACR) Annual Meeting; San Diego, California; April 5 – 10, 2024.
▼ Ce médicament fait l’objet d’une surveillance supplémentaire. Pour plus d’informations, se référer à l’information professionnelle de WELIREG® disponible sous www.swissmedicinfo.ch.
Avant la prescription, veuillez consulter l’information professionnelle complète publiée sur www.swissmedicinfo.ch.
