Tolérance
Effets indésirables liés au traitement sous WELIREG® chez ≥ 10 % des patient(e)s dans l’étude LITESPARK-0041
Analyse de suivi à 49.9 (48.2 – 58.1) mois1
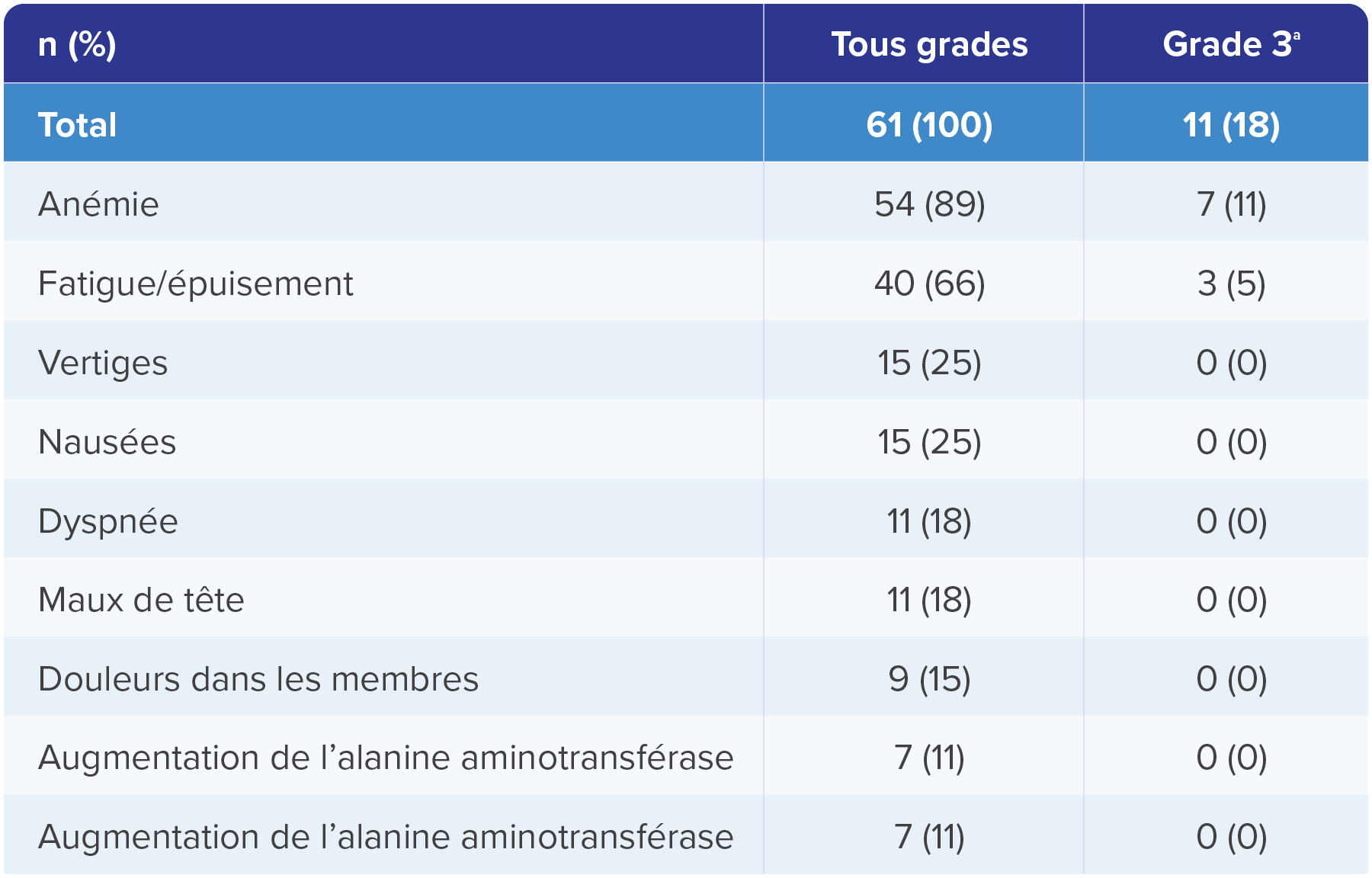
Adapté d’après Srinivasan R., et al., AACR 2024.1
a. Les autres EI de grade 3 chez 1 patient(e) étaient: ampoules, hypoxie et infection des voies urinaires.
Aucun effet indésirable de grade 4 ou 5 n’a été observé.1
Durée médiane de suivi entre la première dose et la date butoir pour les données (3 avril 2023) : 49.9 mois (intervalles: 48.2-58.1).
Effets indésirables les plus fréquents sous WELIREG®2 (mise à jour: mai 2024)

Adapté d’après l’information professionnelle de WELIREG®, mise à jour: mai 2024.2
L’évaluation de la sécurité du WELIREG® est basée sur les données de sécurité de 576 patient(e)s provenant de quatre études cliniques (LS-001, LS-004, LS-005 et LS-013), qui incluaient également des patient(e)s atteint(e)s de tumeurs solides avancées, d’un RCC associé à la VHL et d’un RCC avancé.2
Seulement 2.3% des patient(e)s ont arrêté de manière permanente de prendre WELIREG® à cause d’EI liés au traitement.2
La durée médiane d’exposition au WELIREG® était de 13.5 mois (étendue: de 0.1 à 55.4 mois).2
Des effets indésirables graves sont survenus chez 12.2% des patient(e)s traité(e)s par WELIREG® et incluaient l’hypoxie (7.1%), l’anémie (4.7%) et la dyspnée (1.2%).2
Chez environ 17.7% des patient(e)s, le traitement par WELIREG® a été interrompu en raison des effets indésirables. Les effets indésirables ayant le plus fréquemment entraîné une interruption du traitement par WELIREG® étaient l’anémie (7.1%), l’hypoxie (5.4%), la fatigue/l’épuisement (2.6%) et les nausées (2.4%).2
Chez environ 11.6% des patient(e)s, la dose de WELIREG® a été réduite en raison d’effets indésirables. Les effets indésirables ayant le plus fréquemment entraîné une réduction de la dose de WELIREG® étaient l’hypoxie (6.3%), l’anémie (3.8%) et la fatigue/l’épuisement (1.7%).2
Mises en garde et précautions2
- Dans les données de sécurité groupées, une anémie a été observée chez 84.2% des patient(e)s, 28.8% d’entre eux ayant présenté une anémie de grade 3-4. Le délai d’apparition médian d’une anémie, tous degrés de sévérité confondus, était de 51.7 jours (intervalle: de 1 jour à 27.4 mois). L’anémie a entraîné l’interruption du traitement à l’étude chez 41 (7.1%) participant(e)s et une réduction de la posologie chez 22 (3.8%) participant(e)s. L’anémie a causé l’arrêt définitif du traitement chez 2 (0.3) participant(e)s. Selon le rapport, 165 (34%) participant(e)s s’étaient rétabli(e)s de leur anémie et 249 (51%) ne s’étaient pas encore rétabli(e)s.
- Il convient de surveiller les éventuels signes d’anémie chez les patient(e)s avant d’instaurer le traitement par WELIREG®, puis régulièrement au cours du traitement, la surveillance devant être plus fréquente au cours des 6 premiers mois de traitement.
- Chez les patient(e)s qui développent une anémie de grade 3 (Hb <8 g/dl), il faut suspendre le traitement par WELIREG® et traiter les patient(e)s conformément à la pratique médicale courante. En cas d’anémie récurrente de grade 3, il faut arrêter le traitement par WELIREG®. Chez les patient(e)s qui développent une anémie de grade 4, il faut diminuer la dose de WELIREG® ou arrêter définitivement le médicament.
- L’administration d’agents stimulant l’érythropoïèse (ASE) pour le traitement d’une anémie n’est pas recommandée chez les patient(e)s traité(e)s par WELIREG®.
- Dans les données de sécurité groupées, une hypoxie a été observée chez 94 (16.3%) patient(e)s, 70 (12.2%) d’entre eux ayant présenté une hypoxie de grade 3-4. L’hypoxie a entraîné l’interruption du traitement à l’étude chez 31 (5.4%) participant(e)s, une réduction de la posologie chez 36 (6.3%) participant(e)s et un arrêt définitif du traitement chez 8 (1.4%) participant(e)s.
- Il convient de surveiller le taux de saturation en oxygène par oxymétrie de pouls avant d’instaurer le traitement par WELIREG®, puis régulièrement au cours du traitement, la surveillance devant être plus fréquente au cours des 6 premiers mois de traitement. Au vu du risque d’hypoxie, il est recommandé aux patient(e)s d’arrêter de fumer.
- En cas d’hypoxie de grade 2, il faut administrer une oxygénothérapie complémentaire et envisager de poursuivre ou de suspendre le traitement. Si le traitement par WELIREG® est suspendu, il convient de le reprendre en réduisant la dose. Chez les patient(e)s présentant une hypoxie de grade 3, il faut suspendre le traitement par WELIREG®, traiter l’hypoxie et envisager une réduction de la dose. Si l’hypoxie de grade 3 réapparaît, il faut arrêter le traitement. En cas d’hypoxie de grade 4, il faut arrêter définitivement le traitement.
- L’évaluation de la sécurité du WELIREG® se fonde sur les données de sécurité groupées de 576 patient(e)s de quatre études cliniques, l’étude 001 (58 patient[e]s), l’étude 004 (61 patient[e]s), l’étude 005 (381 patient[e]s dont des patient[e]s japonais[es]) et l’étude 013 (76 patient[e]s), réalisées avec la dose recommandée de 120 mg de WELIREG® une fois par jour chez des patient(e)s présentant des tumeurs solides à un stade avancé, des CCR associés à la maladie de VHL ainsi que des CCR à un stade avancé. La durée médiane d’exposition au WELIREG® était de 13.5 mois (étendue: de 0.1 à 55.4 mois). Les effets indésirables les plus fréquents sous traitement par WELIREG® étaient l’anémie (83.2%), la fatigue/l’épuisement (42.7%), les nausées (24.1%), la dyspnée (21.4%), la sensation vertigineuse (17.9%) et l’hypoxie (16.3%).
- Les effets indésirables de grade 3 ou 4 les plus fréquents étaient l’anémie (28.8%) et l’hypoxie (12.2%). Des effets indésirables graves sont survenus chez 12.2% des patient(e)s traité(e)s par WELIREG® et incluaient l’hypoxie (7.1%), l’anémie (4.7%) et la dyspnée (1.2%). Chez environ 17.7% des patient(e)s, le traitement par WELIREG® a été interrompu en raison des effets indésirables. Les effets indésirables ayant le plus fréquemment entraîné une interruption du traitement par WELIREG® étaient l’anémie (7.1%), l’hypoxie (5.4%), la fatigue/l’épuisement (2.6%) et les nausées (2.4%). Chez environ 11.6% des patient(e)s, la dose du WELIREG® a été réduite en raison d’effets indésirables. Les effets indésirables ayant le plus fréquemment entraîné une réduction de la dose de WELIREG® étaient l’hypoxie (6.3%), l’anémie (3.8%) et la fatigue/l’épuisement (1.7%). Chez environ 2.3% des patient(e)s, le traitement par WELIREG® a été arrêté en raison d’effets indésirables. L’effet indésirable ayant le plus fréquemment entraîné un arrêt du WELIREG® était l’hypoxie (1.4%).
- Dans une étude clinique, l’administration répétée de WELIREG®, à une dose de 120 mg une fois par jour, a entraîné une diminution de l’ASC du midazolam de 40%, un effet qui est compatible avec un inducteur faible du CYP3A4. D’après la modélisation PBPK, WELIREG® peut présenter une induction modérée du CYP3A4 chez les patient(e)s soumis(es) à une exposition plasmatique plus forte au WELIREG®.
- L’administration concomitante de WELIREG® et de substrats du CYP3A4, y compris les contraceptifs hormonaux, diminue les concentrations en substrats du CYP3A4 et peut donc diminuer l’efficacité de ces substrats.
- Évitez l’administration concomitante de WELIREG® et de substrats sensibles du CYP3A4 pour lesquels une faible réduction de la concentration peut entraîner l’échec du traitement par ce substrat. S’il n’est pas possible d’éviter l’administration concomitante, augmentez la dose du substrat sensible du CYP3A4 conformément à l’information professionnelle correspondante.
- L’administration concomitante de WELIREG® et de contraceptifs hormonaux peut entraîner l’échec de la contraception ou une augmentation des métrorragies.
-
Effet d’autres médicaments sur WELIREG®
L’administration concomitante de WELIREG® et d’inhibiteurs de l’UGT2B17 ou du CYP2C19 entraîne une augmentation de l’exposition plasmatique au WELIREG® qui est susceptible d’augmenter l’incidence et le degré de sévérité des effets indésirables du WELIREG®. Il convient de surveiller les éventuels signes d’anémie et d’hypoxie et de réduire la dose de WELIREG® conformément aux recommandations.
- Les résultats des études expérimentales chez l’animal indiquent que WELIREG® peut altérer la fertilité des hommes et des femmes en âge de procréer. Les patientes et patients doivent être informés de ce risque. On ignore si les effets sur la fertilité sont réversibles. Le cas échéant, il convient de discuter de la planification familiale avec la patiente ou le patient.
-
Femmes
Il faut conseiller aux femmes en âge de procréer d’utiliser une méthode de contraception hautement efficace pendant le traitement par WELIREG® et au moins une semaine après la dernière dose. Le traitement par WELIREG® peut diminuer l’efficacité des contraceptifs hormonaux. Il faut recommander aux patientes sous contraceptif hormonal une autre méthode de contraception non hormonale ou les inciter à demander à leurs partenaires masculins d’utiliser un préservatif pendant la durée du traitement par WELIREG®. -
Hommes
Il faut recommander aux patients de sexe masculin et à leurs partenaires féminines en âge de procréer d’utiliser une méthode de contraception hautement efficace pendant le traitement du patient par WELIREG® et au moins une semaine après la dernière dose. Il faut conseiller aux patients de sexe masculin dont la partenaire est enceinte d’utiliser une méthode contraceptive de type barrière pendant le traitement par WELIREG® et une semaine après la dernière dose.
- Il n’existe pas de données sur l’utilisation du WELIREG® chez la femme enceinte. Les études expérimentales chez l’animal ont révélé une toxicité sur la reproduction. WELIREG® ne doit pas être administré pendant la grossesse ni chez les femmes en âge de procréer qui n’utilisent pas de contraceptif.
- On ignore si WELIREG® ou ses métabolites sont excrétés dans le lait maternel. Il n’est pas possible d’exclure un risque pour le nouveau-né ou le nourrisson. Il convient d’interrompre l’allaitement pendant le traitement par WELIREG® et pendant une semaine après la dernière dose.
Plan de l’étude LITESPARK-0043
L’étude ouverte de phase II comprenait 61 adultes de 18 ans et plus ayant reçu un diagnostic de maladie de VHL provenant d’une mutation germinale du gène VHL. Les patientes et patients devaient présenter au moins un carcinome à cellules rénales mesurable, mais pas supérieur à 3 cm, et aucune autre néoplasie liée à la maladie de VHL qui aurait nécessité une opération immédiate. Les patient(e)s inclu(e)s présentaient d’autres tumeurs associées à la maladie de VHL documentées par radiologie, telles que des hémangioblastomes du SNC et des TNEp. Le traitement était administré par voie orale à la dose de 120 mg une fois par jour (trois comprimés de 40 mg chacun). Les patient(e)s ont subi un examen radiologique env. 12 semaines après le début du traitement, puis toutes les 12 semaines pendant le traitement à l’étude d’au moins 3 ans. Le principal critère d’évaluation était le taux de réponse objective au traitement par belzutifan (réponse complète ou réponse partielle) d’après les critères RECIST, version 1.1, chez les patient(e)s présentant un carcinome à cellules rénales associé à la maladie de VHL. Les critères d’évaluation secondaires comprenaient la durée de réponse, le délai de réponse et la survie sans progression, et des critères d’évaluation supplémentaires pour les lésions pancréatiques, les hémangioblastomes du SNC et les TNEp, ainsi que la sécurité du belzutifan.3
Abréviations:
CCR: carcinome a cellules renales; EI: effet indésirable; VHL: Von-Hippel-Lindau.
Références:
- Srinivasan R, et al. Belzutifan, a Hypoxia-Inducible Factor-2α Inhibitor, for von Hippel-Lindau Disease–Associated Neoplasms: Long-Term Results of the Phase 2 LITESPARK-004 Study. Presented at the American Association for Cancer Research (AACR) Annual Meeting; San Diego, California; April 5 – 10, 2024.
- Information professionnelle de WELIREG® (Belzutifan), www.swissmedicinfo.ch, dernière consultation le 07.03.2025.
- Jonasch E, et al. Belzutifan for Renal Cell Carcinoma in von Hippel-Lindau Disease. N Engl J Med. 2021;385:2036 – 2046. DOI: 10.1056/NEJMoa2103425.
▼ Ce médicament fait l’objet d’une surveillance supplémentaire. Pour plus d’informations, se référer à l’information professionnelle de WELIREG® disponible sous www.swissmedicinfo.ch.
Avant la prescription, veuillez consulter l’information professionnelle complète publiée sur www.swissmedicinfo.ch.
