Efficacia
L’efficacia e la sicurezza di WELIREG® rispetto all’everolimus sono state studiate nello studio di fase 3 LITESPARK-005.1,2
Disegno dello studio LITESPARK-0052
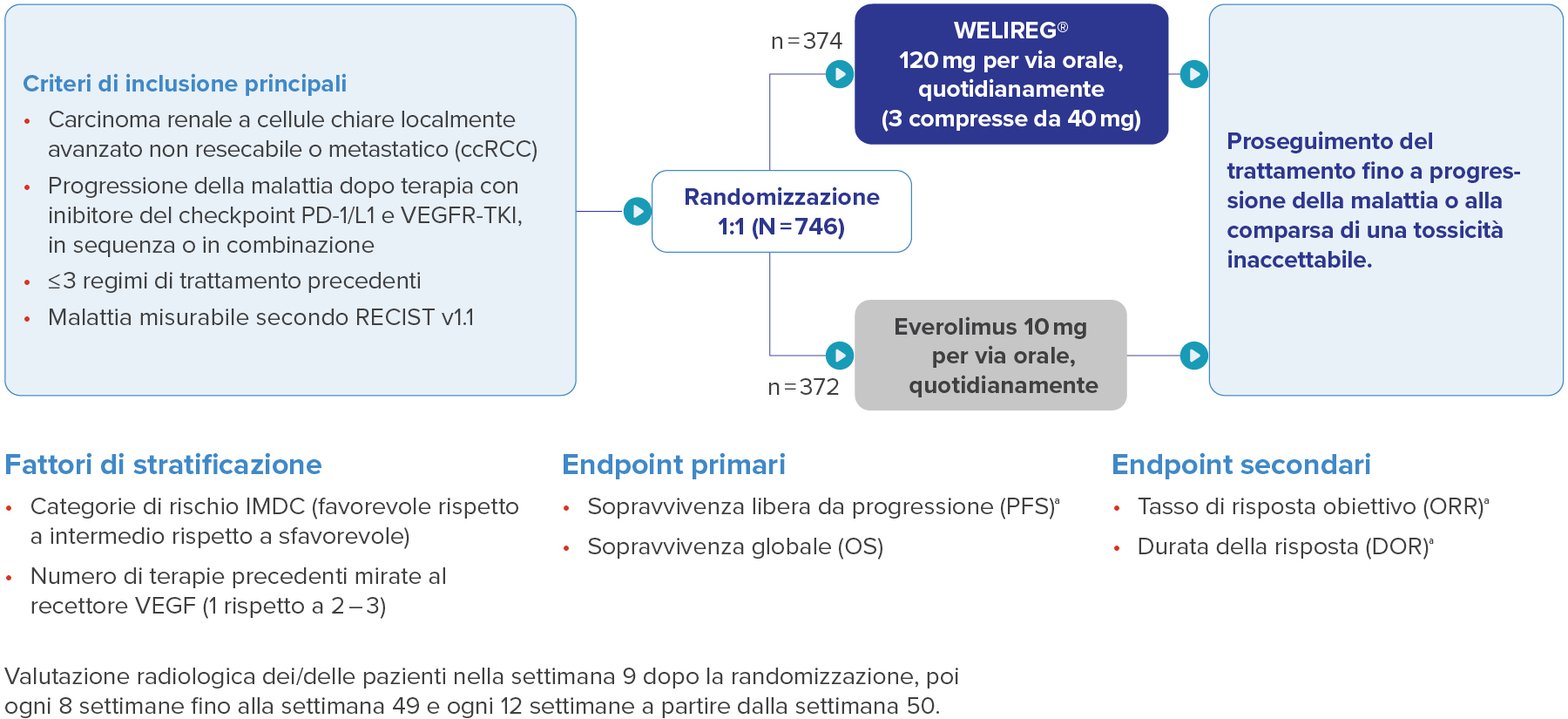
Nello studio clinico LITESPARK-005 sono stati inclusi pazienti che hanno ricevuto belzutifan a partire dalla seconda linea (2L+). La preghiamo di notare che attualmente in Svizzera belzutifan è omologato per il trattamento del carcinoma a cellule renali avanzato solo per pazienti a partire dalla terza linea (3L+).1
Immagine adattata da Rini B, et al. ESMO 2024.2
a. Valutata con BICR secondo RECIST-v1.1.
Caratteristiche dei/delle pazienti2

Nello studio clinico LITESPARK-005 sono stati inclusi pazienti che hanno ricevuto belzutifan a partire dalla seconda linea (2L+). La preghiamo di notare che attualmente in Svizzera belzutifan è omologato per il trattamento del carcinoma a cellule renali avanzato solo per pazienti a partire dalla terza linea (3L+).1
Tabella adattata da Rini B, et al. ESMO 2024.2
a. Lo 0.3% dei pazienti in ciascun braccio di trattamento non aveva un punteggio KPS.
b. Lo 0.5% dei pazienti nel braccio WELIREG® e l’1.1% nel braccio everolimus avevano ricevuto 4 terapie precedenti (violazione del protocollo).
Riepilogo dell’efficacia di WELIREG® nello studio LITESPARK-0051
La tabella riassume i risultati di efficacia della prima analisi ad interim predefinita per l’RCC avanzato nello studio LITESPARK-005.1
Nell’analisi finale, dopo un periodo di follow-up mediano di 19.6 mesi, l’OS non ha raggiunto una significatività statistica (HR = 0.92, IC al 95 %: 0.77 -1 .10; maturità dei dati dell’OS 69 %).1

Nello studio clinico LITESPARK-005 sono stati inclusi pazienti che hanno ricevuto belzutifan a partire dalla seconda linea (2L+). La preghiamo di notare che attualmente in Svizzera belzutifan è omologato per il trattamento del carcinoma a cellule renali avanzato solo per pazienti a partire dalla terza linea (3L+).1
Tabella adattata dall’informazione professionale di WELIREG®.1
* Basato sul modello di regressione stratificato di Cox.
** Sulla base del metodo del valore limite del prodotto (Kaplan-Meier) per dati censurati.
PFS nello studio LITESPARK-005 alla prima analisi ad interim con un follow-up mediano di 18.4 mesi3
PFS migliorata significativamente con WELIREG® rispetto a everolimus (p bilaterale = 0.002)3,*
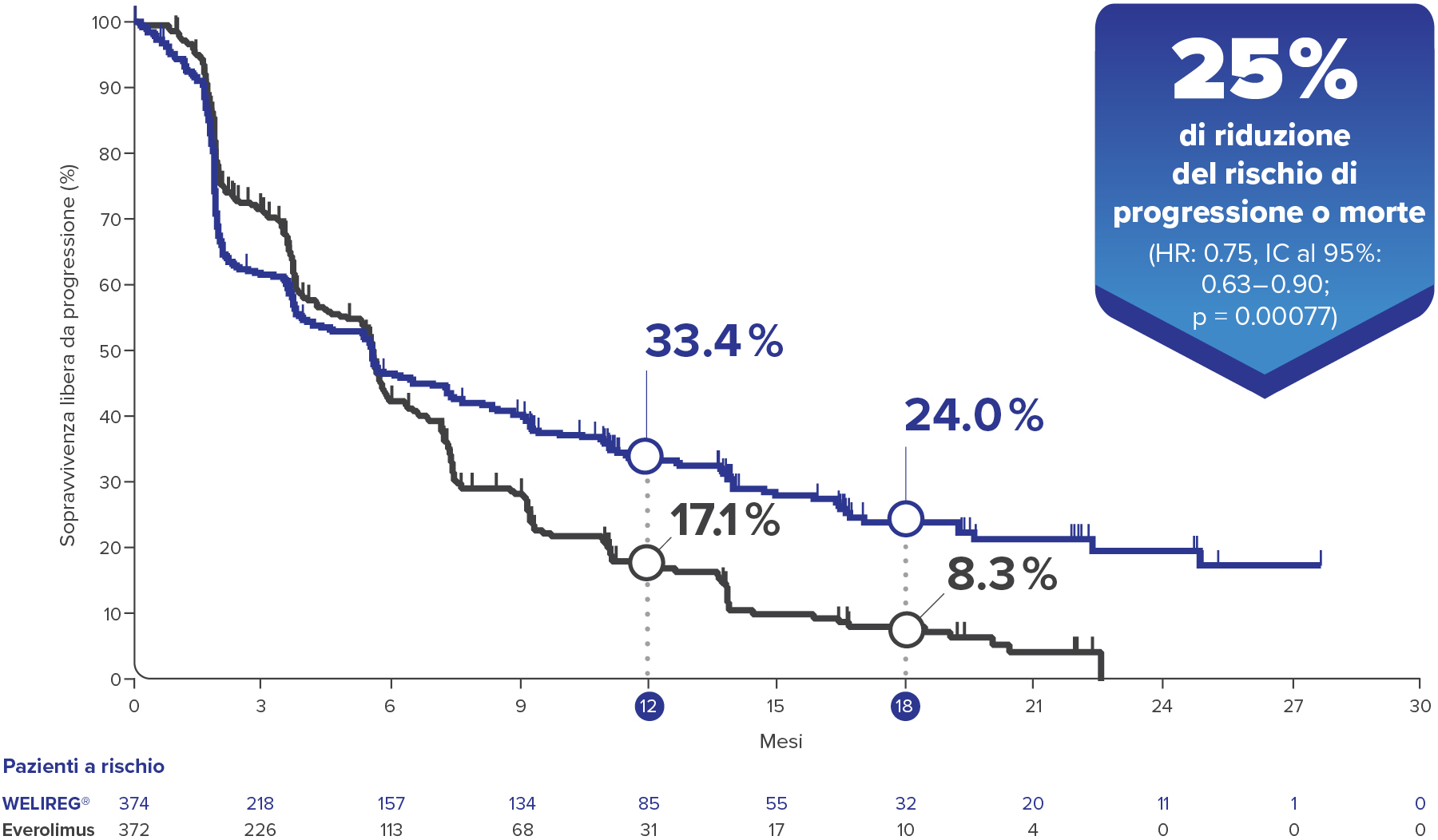
Nello studio clinico LITESPARK-005 sono stati inclusi pazienti che hanno ricevuto belzutifan a partire dalla seconda linea (2L+). La preghiamo di notare che attualmente in Svizzera belzutifan è omologato per il trattamento del carcinoma a cellule renali avanzato solo per pazienti a partire dalla terza linea (3L+).1
Grafico adattato da Choueiri TK, et al. NEJM 2024.3
* Valutata con BICR secondo RECIST-v1.1.
OS nello studio LITESPARK-005 all’analisi finale dell’efficacia con un follow-up mediano di 35.8 mesi2
OS con WELIREG® rispetto a Everolimus2
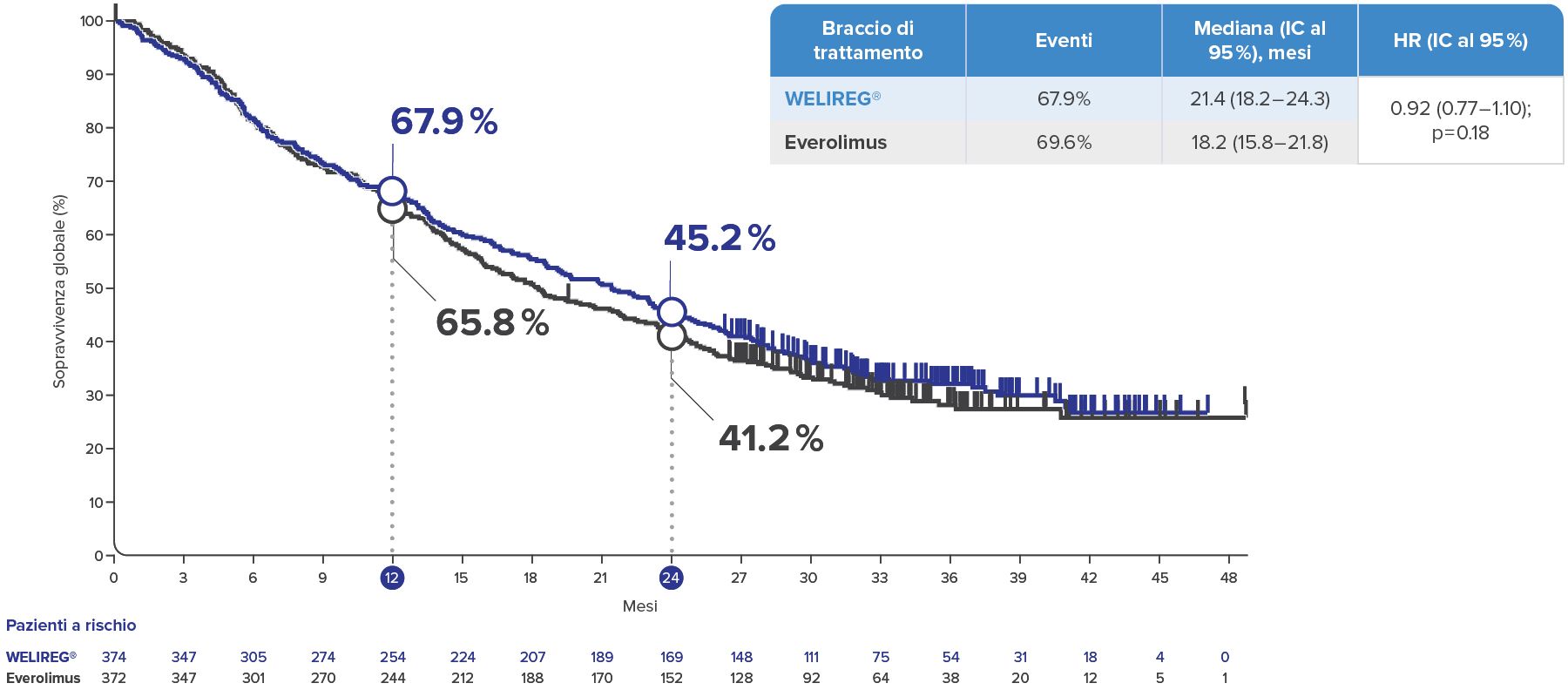
Nello studio clinico LITESPARK-005 sono stati inclusi pazienti che hanno ricevuto belzutifan a partire dalla seconda linea (2L+). La preghiamo di notare che attualmente in Svizzera belzutifan è omologato per il trattamento del carcinoma a cellule renali avanzato solo per pazienti a partire dalla terza linea (3L+).1
Grafico adattato da Rini B, et al. ESMO 2024.2
Periodo medio di follow-up dalla randomizzazione alla data di riferimento dei dati (15 aprile 2024): 35.8 mesi.
LIMITAZIONE: per le analisi aggiornate della PFS, dell’ORR e della DOR non sono stati effettuati test statistici. Non è possibile trarre conclusioni.
ORR nello studio LITESPARK-005 alla prima analisi ad interim: risposta superiore con WELIREG® rispetto a everolimus1,*
82 pazienti con ORR sotto WELIREG® rispetto a 13 pazienti sotto everolimus (p < 0.00001)1
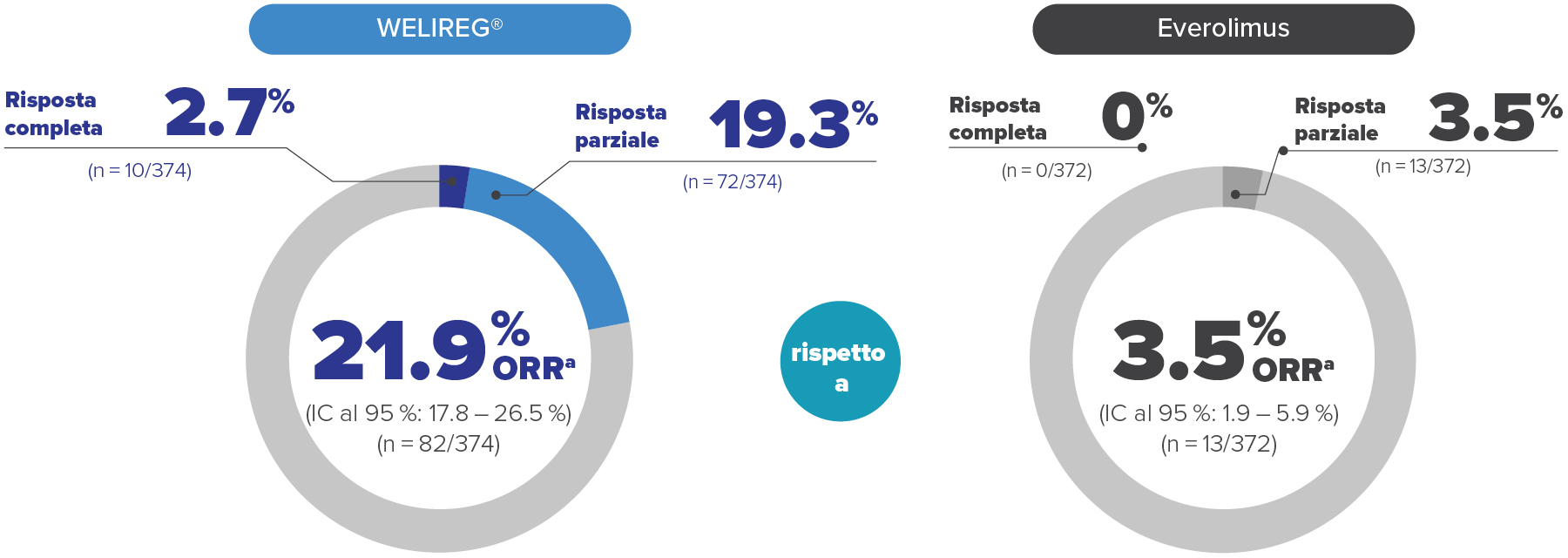
Nello studio clinico LITESPARK-005 sono stati inclusi pazienti che hanno ricevuto belzutifan a partire dalla seconda linea (2L+). La preghiamo di notare che attualmente in Svizzera belzutifan è omologato per il trattamento del carcinoma a cellule renali avanzato solo per pazienti a partire dalla terza linea (3L+).1
Immagine adattata da der Fachinformation von WELIREG®.1
* Valutato con BICR secondo RECIST-v1.1.
a. L’ORR era un ndpoint secondario principale.
Abbreviazioni:
BICR: valutazione centrale indipendente in cieco (blinded independent central view); ccRCC: carcinoma a cellule renali a cellule chiare (clear cell renal cell carcinoma); DOR: durata della risposta (duration of response); HR: Hazard Ratio; IC: intervallo di confidenza; IMDC: International Metastatic RCC Database Consortium; KPS: Scala della performace di Karnofsky (Karnofsky performance status); ORR: tasso di risposta obiettiva (objective response rate); OS: sopravvivenza globale (overall survival); PD-1: proteina 1 della morte cellulare programmata (programmed cell death protein 1); PD-L1: ligando 1 della morte cellulare programmata (Programmed death-ligand 1); PFS: sopravvivenza libera da progressione (progression-free survival); RCC: carcinoma a cellule renali (renal cell carcinoma); RECIST v1.1: Response Evaluation Criteria in Solid Tumors version 1.1; TKI: inibitore delle tirosin-chinasi (tyrosine kinase inhibitor); VEGF/R: fattore di crescita/recettore del fattore di crescita dell’endotelio vascolare (vascular endothelial growth factor/receptor).
Riferimenti bibliografici:
- Informazione professionale di WELIREG® (belzutifan), www.swissmedicinfo.ch, ultima consultazione il 22.08.2025.
- Rini B, et al. Final Analysis of the Phase 3 LITESPARK-005 Study of Belzutifan versus Everolimus in participant with previously treated advanced clear cell renal cell carcinoma presented at ESMO 2024, Barcelona, 13.–17. September 2024.
- Choueiri TK, et al. Belzutifan versus Everolimus for Advanced Renal-Cell Carcinoma. N Engl J Med. 2024;391:710 – 21.
▼ Questo medicamento è soggetto a monitoraggio addizionale. Per ulteriori informazioni, vedere l’informazione professionale di WELIREG® su www.swissmedicinfo.ch.
Prima della prescrizione, consultare l’informazione professionale completa pubblicata sul sito www.swissmedicinfo.ch.
