Tollerabilità
Effetti indesiderati correlati al trattamento con WELIREG® in ≥ 10% dei/delle pazienti nello studio LITESPARK-0041
Analisi di follow-up a 49.9 mesi (intervallo: 48.2–58.1 mesi)1
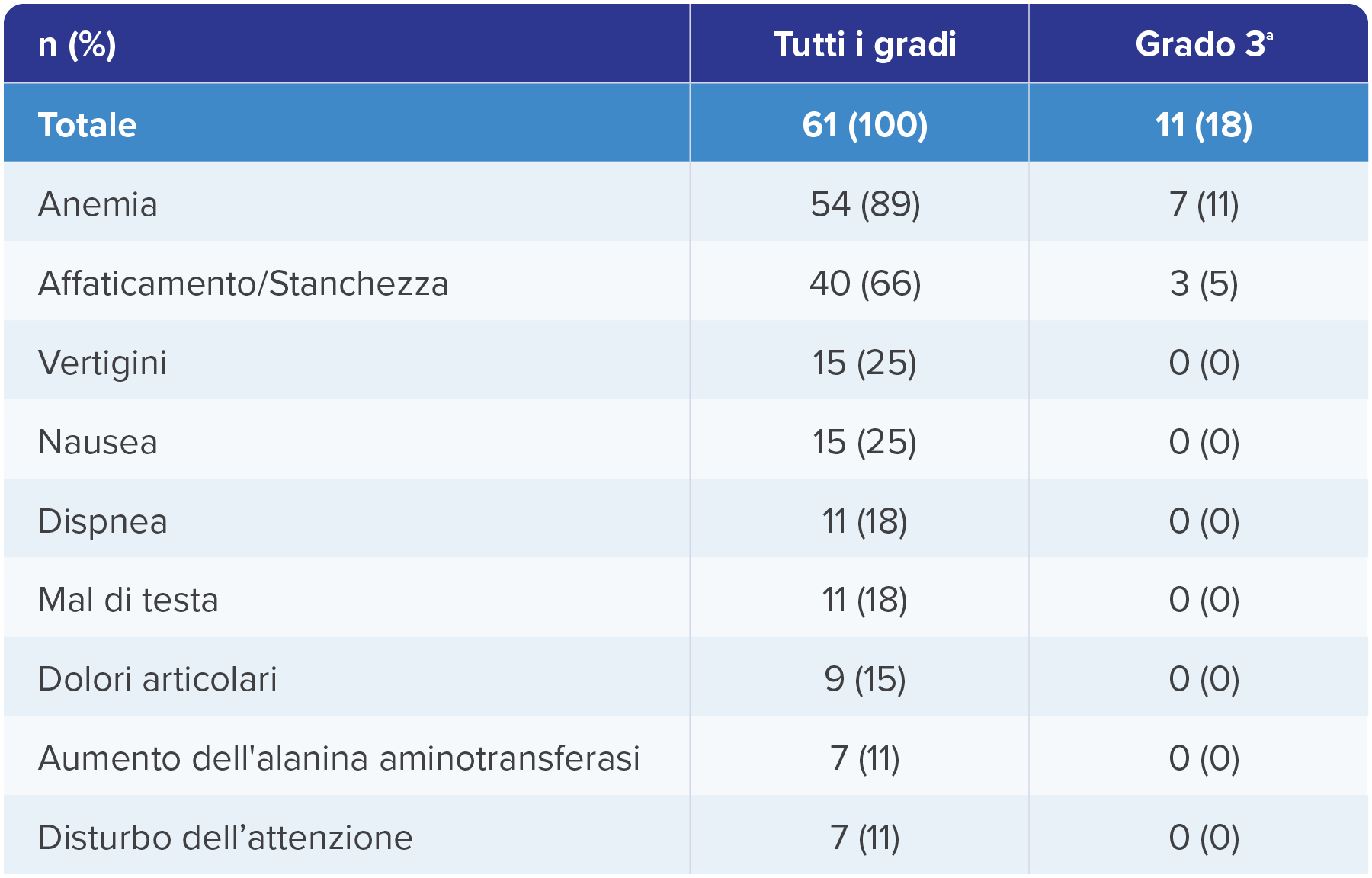
Adattato da Srinivasan R., et al., AACR 2024.1
a. Altri EI di grado 3 in 1 paziente ciascuno sono stati: vesciche, ipossia e infezione del tratto urinario.
Non si sono verificati effetti indesiderati di grado 4 o 5.1
Tempo mediano di follow-up dalla prima dose fino alla data di cut-off dei dati (3 aprile 2023): 49.9 mesi (intervallo: 48.2–58.1).
Effetti indesiderati più frequenti sotto WELIREG® 2 (aggiornato a maggio 2024)
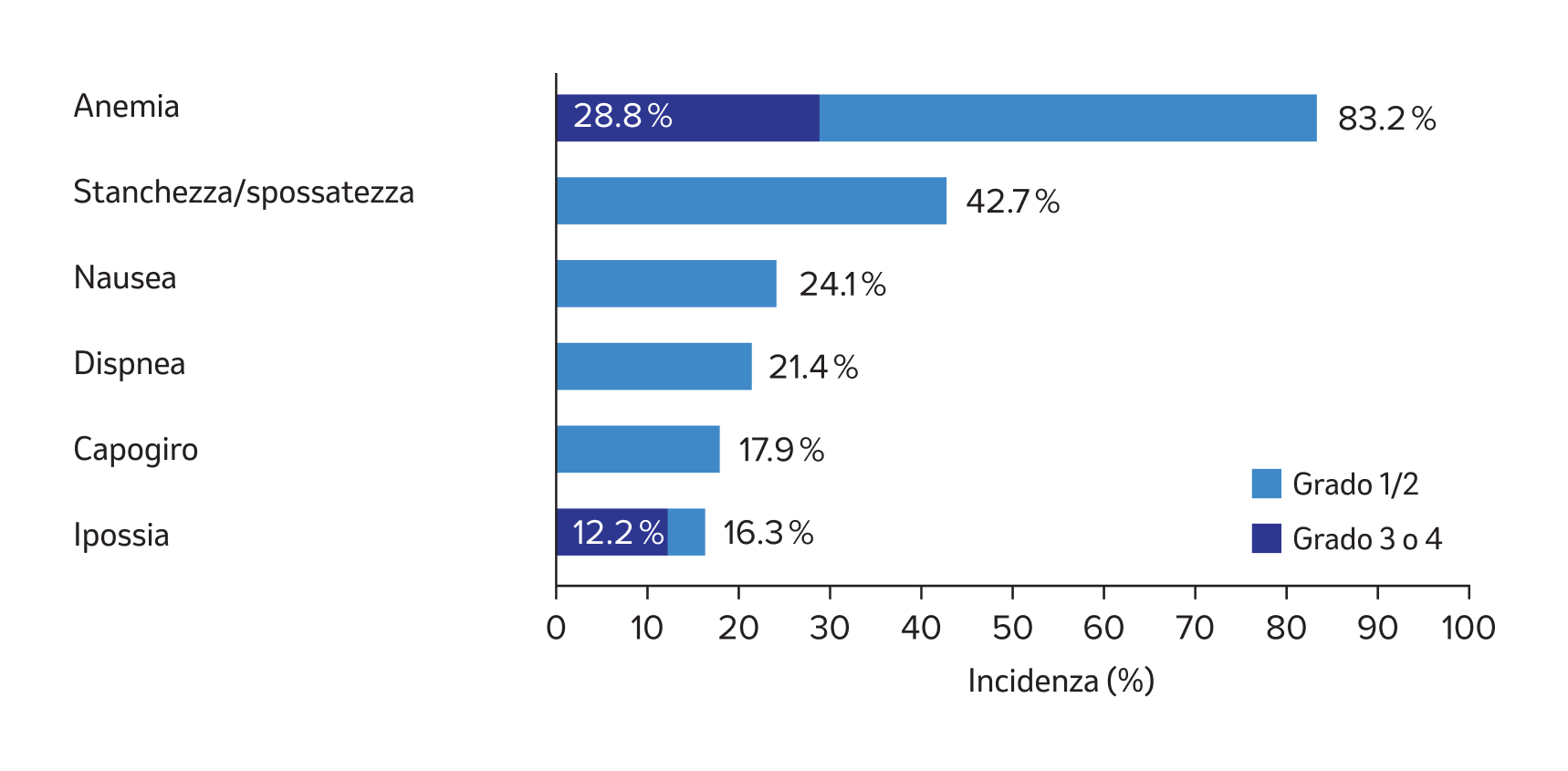
Adattato dall’informazione professionale di WELIREG®, aggiornata a maggio 2024.2
La valutazione della sicurezza di WELIREG® si basa sui dati di sicurezza relativi a 576 pazienti di quattro studi clinici (LS-001, LS-004, LS-005 e LS-013) che includevano pazienti con tumori solidi avanzati, RCC associato a VHL e RCC avanzato.2
Soltanto il 2.3% dei/delle pazienti ha sospeso definitivamente WELIREG® a causa di effetti indesiderati correlati al trattamento.2
La durata mediana dell’esposizione al WELIREG® è stata di 13.5 mesi (intervallo: 0.1-55.4 mesi).2
Nel 12.2% dei/delle pazienti trattati/e con WELIREG® sono comparsi effetti indesiderati seri, tra cui ipossia (7.1%), anemia (4.7%) e dispnea (1.2%).2
In circa il 17.7% dei pazienti, il trattamento con WELIREG® è stato interrotto a causa di effetti indesiderati. Gli effetti indesiderati più comuni che hanno portato all’interruzione del trattamento con WELIREG® sono stati anemia (7.1%), ipossia (5.4%), stanchezza/spossatezza (2.6%) e nausea (2.4%).2
BIn circa l’11.6% dei pazienti, la dose di WELIREG® è stata ridotta a causa di effetti indesiderati. Gli effetti indesiderati più comuni che hanno portato a una riduzione della dose di WELIREG® sono stati ipossia (6.3%), anemia (3.8%) e stanchezza/spossatezza (1.7%).2
Avvertenze e misure precauzionali2
- Nei dati di sicurezza aggregati, l’anemia è stata riportata nell’84.2% dei pazienti, di cui il 28.8% presentava un’anemia di grado 3-4. Il tempo mediano alla comparsa di eventi di anemia di tutti i gradi di gravità è stato di 51.7 giorni (intervallo: da 1 giorno a 27.4 mesi). In 41 pazienti (7.1%) sono comparsi eventi di anemia che hanno portato alla sospensione del trattamento in studio, e in 22 pazienti (3.8%) la dose è stata ridotta a causa dell’anemia. In 2 pazienti (0.3%) il trattamento è stato interrotto a causa dell’anemia. Secondo il rapporto, 165 pazienti (34%) si erano ripresi dall’anemia e 249 pazienti (51%) non si erano ancora ripresi.
- Prima dell’inizio e regolarmente durante il trattamento con WELIREG®, i pazienti devono essere monitorati per rilevare eventuali segni di anemia, con un monitoraggio più frequente durante i primi 6 mesi di trattamento.
- Nei pazienti in cui compare un’anemia di grado 3 (Hb <8 g/dl), WELIREG® deve essere sospeso e i pazienti devono essere trattati secondo la prassi medica usuale. In caso di anemia ricorrente di grado 3, il trattamento con WELIREG® deve essere interrotto. Nei pazienti in cui compare un’anemia di grado 4, la dose di WELIREG® deve essere ridotta o il medicamento deve essere interrotto definitivamente.
- L’uso di principi attivi stimolanti l’eritropoiesi (ESA) per il trattamento dell’anemia non è raccomandato nei pazienti in trattamento con WELIREG®.
- Nei dati di sicurezza aggregati, l’ipossia è comparsa in 94 pazienti (16.3%), con ipossia di grado 3-4 in 70 pazienti (12.2%). In 31 pazienti (5.4%) sono comparsi eventi di ipossia che hanno portato alla sospensione del trattamento in studio, in 36 pazienti (6.3%) la dose è stata ridotta a causa dell’ipossia e 8 pazienti (1.4%) hanno interrotto il trattamento a causa dell’ipossia.
- Prima dell’inizio e regolarmente durante il trattamento con WELIREG®, deve essere monitorata la saturazione dell’ossigeno mediante pulsossimetria, con un monitoraggio più frequente durante i primi 6 mesi di trattamento. In considerazione del rischio di ipossia, si raccomanda di smettere di fumare.
- In caso di ipossia di grado 2, si devono prendere in considerazione la somministrazione supplementare di ossigeno e la continuazione o la sospensione del trattamento. Dopo la sospensione, il trattamento con WELIREG® deve essere ripreso a dose ridotta. Nei pazienti con ipossia di grado 3, WELIREG® deve essere sospeso, l’ipossia deve essere trattata e deve essere presa in considerazione una riduzione della dose. Se compare di nuovo un’ipossia di grado 3, il trattamento deve essere terminato. In caso di ipossia di grado 4, il trattamento deve essere interrotto definitivamente.
- La valutazione della sicurezza di WELIREG® si basa sui dati di sicurezza aggregati relativi a 576 pazienti di quattro studi clinici, ossia lo studio 001 (58 pazienti), lo studio 004 (61 pazienti), lo studio 005 (381 pazienti, tra cui pazienti giapponesi) e lo studio 013 (76 pazienti), in cui è stata impiegata la dose raccomandata di 120 mg di WELIREG® una volta al giorno in pazienti con tumori solidi avanzati, RCC associato a VHL e RCC avanzato. La durata mediana dell’esposizione a WELIREG® è stata di 13.5 mesi (intervallo: 0.1-55.4 mesi). Gli effetti indesiderati più comuni con WELIREG® sono stati anemia (83.2%), stanchezza/spossatezza (42.7%), nausea (24.1%), dispnea (21.4%), capogiro (17.9%) e ipossia (16.3%).
- Gli effetti indesiderati di grado 3 o 4 più comuni sono stati anemia (28.8%) e ipossia (12.2%). Nel 12.2% dei pazienti trattati con WELIREG® sono comparsi effetti indesiderati seri, tra cui ipossia (7.1%). anemia (4,7%) e dispnea (1.2%). In circa il 17.7% dei pazienti, il trattamento con WELIREG® è stato interrotto a causa di effetti indesiderati. Gli effetti indesiderati più comuni che hanno portato all’interruzione del trattamento con WELIREG® sono stati anemia (7.1%), ipossia (5.4%), stanchezza/spossatezza (2.6%) e nausea (2.4%). In circa l’11.6% dei pazienti, la dose di WELIREG® è stata ridotta a causa di effetti indesiderati. Gli effetti indesiderati più comuni che hanno portato a una riduzione della dose di WELIREG® sono stati ipossia (6.3%), anemia (3.8%) e stanchezza/spossatezza (1.7%). In circa il 2.3% dei pazienti, WELIREG® è stato sospeso a causa di effetti indesiderati. L’effetto indesiderato più comune che ha portato alla sospensione di WELIREG® è stato l’ipossia (1.4%).
- In uno studio clinico, la somministrazione ripetuta di WELIREG® 120 mg una volta al giorno ha determinato una riduzione del 40% dell’AUC del midazolam, un effetto compatibile con un induttore debole del CYP3A4. Sulla base di un modello PBPK, WELIREG® può mostrare una moderata induzione del CYP3A4 nei pazienti con una maggiore esposizione plasmatica a WELIREG®.
- La somministrazione concomitante di WELIREG® con substrati del CYP3A4, compresi i contraccettivi ormonali, riduce le concentrazioni dei substrati del CYP3A4, il che può diminuire l’efficacia di questi substrati.
- Evitare la somministrazione concomitante di WELIREG® con substrati sensibili del CYP3A4, per i quali una minima riduzione della concentrazione può comportare un fallimento terapeutico del substrato. Se la somministrazione concomitante non può essere evitata, aumentare la dose del substrato sensibile del CYP3A4 secondo la rispettiva informazione professionale.
- La somministrazione concomitante di WELIREG® con contraccettivi ormonali può causare un fallimento della contraccezione o un aumento dei sanguinamenti intermestruali.
-
Effetto di altri medicamenti su WELIREG®
La somministrazione concomitante di WELIREG® con inibitori di UGT2B17 o di CYP2C19 aumenta l’esposizione plasmatica a WELIREG®, il che può aumentare l’incidenza e il grado di gravità degli effetti indesiderati di WELIREG®. Monitorare l’anemia e l’ipossia e ridurre la dose di WELIREG® come raccomandato.
- Sulla base dei risultati degli studi sugli animali, WELIREG® può compromettere la fertilità nell’uomo e nella donna in età fertile. I/le pazienti devono essere informati/e di questo possibile rischio. Non è noto se l’effetto sulla fertilità sia reversibile. Se necessario, discutere la pianificazione familiare con i/le pazienti.
-
Donne
Alle donne in età fertile va raccomandato di utilizzare un metodo contraccettivo altamente efficace durante il trattamento con WELIREG® e per almeno 1 settimana dopo l’ultima dose. L’uso di WELIREG® può ridurre l’efficacia dei contraccettivi ormonali. Alle pazienti che utilizzano contraccettivi ormonali deve essere raccomandato di utilizzare un metodo contraccettivo alternativo non ormonale o di chiedere al partner maschile di utilizzare il preservativo durante il trattamento con WELIREG®. -
Uomini
Ai pazienti di sesso maschile e alle loro partner in età fertile va raccomandato di utilizzare un metodo contraccettivo altamente efficace durante il trattamento del paziente maschile con WELIREG® e per almeno 1 settimana dopo l’ultima dose. Ai pazienti di sesso maschile con partner in gravidanza va raccomandato di utilizzare un metodo contraccettivo di barriera durante il trattamento con WELIREG® e per 1 settimana dopo l’ultima dose.
- Non sono disponibili dati sull’uso del WELIREG® in donne in gravidanza. Studi sperimentali sugli animali hanno messo in evidenza una tossicità per la riproduzione. WELIREG® non deve essere usato durante la gravidanza e in donne in età fertile che non utilizzano contraccettivi.
- Non è noto se nell’essere umano WELIREG® o i suoi metaboliti passino nel latte materno. Non si può escludere un rischio per i neonati/lattanti. L’allattamento deve essere interrotto durante il trattamento con WELIREG® e per 1 settimana dopo l’ultima dose.
Disegno dello studio LITESPARK-0043
Lo studio di fase II in aperto includeva 61 adulti di età pari o superiore a 18 anni a cui era stata diagnosticata una malattia associata a VHL dovuta a una mutazione di VHL nella linea germinale. I/Le pazienti dovevano avere almeno un carcinoma a cellule renali misurabile che non fosse più grande di 3 cm e nessuna altra neoplasia associata a VHL che richiedesse un intervento chirurgico immediato. I/Le pazienti inclusi/e avevano altri tumori associati a VHL, documentati radiologicamente, come emangioblastomi del sistema nervoso centrale e pNET. Il trattamento è stato somministrato per via orale alla dose di 120 mg una volta al giorno (in tre compresse da 40 mg ciascuna). I/Le pazienti sono stati/e sottoposti/e a esame radiologico circa 12 settimane dopo l’inizio del trattamento e successivamente ogni 12 settimane, mentre il trattamento dello studio è stato continuato per almeno 3 anni. L’endpoint primario era il tasso di risposta obiettiva al trattamento con belzutifan (risposta completa o risposta parziale), secondo RECIST versione 1.1, nei pazienti con carcinoma a cellule renali associato alla malattia di VHL. Gli endpoint secondari includevano la durata della risposta, il tempo alla risposta e la sopravvivenza libera da progressione e endpoint aggiuntivi per lesioni pancreatiche, emangioblastomi del SNC e pNET, nonché la sicurezza del belzutifan.3
Abbreviazioni:
EI: effetto indesiderato; RCC: carcinoma a cellule renali (renal cell carcinoma); VHL: Von-Hippel-Lindau.
Riferimenti bibliografici:
- Srinivasan R, et al. Belzutifan, a Hypoxia-Inducible Factor-2α Inhibitor, for von Hippel-Lindau Disease–Associated Neoplasms: Long-Term Results of the Phase 2 LITESPARK-004 Study. Presented at the American Association for Cancer Research (AACR) Annual Meeting; San Diego, California; April 5 – 10, 2024.
- Informazione professionale di WELIREG® (belzutifan), www.swissmedicinfo.ch, ultima consultazione il 07.03.2025.
- Jonasch E, et al. Belzutifan for Renal Cell Carcinoma in von Hippel-Lindau Disease. N Engl J Med. 2021;385:2036 – 2046. DOI: 10.1056/NEJMoa2103425.
▼ Questo medicamento è soggetto a monitoraggio addizionale. Per ulteriori informazioni, vedere l’informazione professionale di WELIREG® su www.swissmedicinfo.ch.
Prima della prescrizione, consultare l’informazione professionale completa pubblicata sul sito www.swissmedicinfo.ch.
