Efficacia
Die Wirksamkeit und die Sicherheit von WELIREG® wurden in der Phase 2-Studie LITESPARK-004 untersucht.1,2
Disegno dello studio2

Adattato dall’informazione professionale di WELIREG®1 e Jonasch E, et al. , NEJM 2021.2
a. La risposta secondo RECIST v1.1 è stata definita come una riduzione ≥ 30% della somma dei diametri delle lesioni target, dove la somma dei diametri al basale è stata utilizzata come riferimento.1,3

Adattato dall’informazione professionale di WELIREG®1 e Jonasch E, et al. , NEJM 2021.2
Risultati a lungo termine dello studio di fase 2 LITESPARK-004 con un follow-up mediano di 49.9 (48.2 – 58.1) mesi4
Lo studio LITESPARK-004, con un follow-up mediano di oltre 4 anni, ha dimostrato che WELIREG® ha un effetto antitumorale duraturo nei tumori associati alla VHL.4
- Il 75% (n = 46) dei/delle pazienti ha subito un totale di 86 procedure di riduzione del tumore nei quattro anni precedenti l’inizio della terapia. Il 26% (n = 16) dei/delle pazienti ha subito 18 procedure di riduzione del tumore dopo l’inizio del trattamento con WELIREG®.4
- Il 59% (n = 36) dei/delle pazienti era ancora in trattamento alla data di cut-off dei dati.4
- Il profilo di sicurezza è rimasto sostanzialmente invariato.4

Adattato da Srinivasan R., et al., AACR 2024.4
a. Dati insufficienti per la valutazione della risposta secondo RECIST v1.1.
+ indica che la risposta è ancora in corso.
Tempo mediano di follow-up dalla prima dose fino alla data di cut-off dei dati (3 aprile 2023): 49.9 mesi (intervallo: 48.2–58.1).
WELIREG® ha ridotto le dimensioni degli RCC associati alla VHL4
BIn 41 pazienti (67%) si è verificata una riduzione della lesione target.4
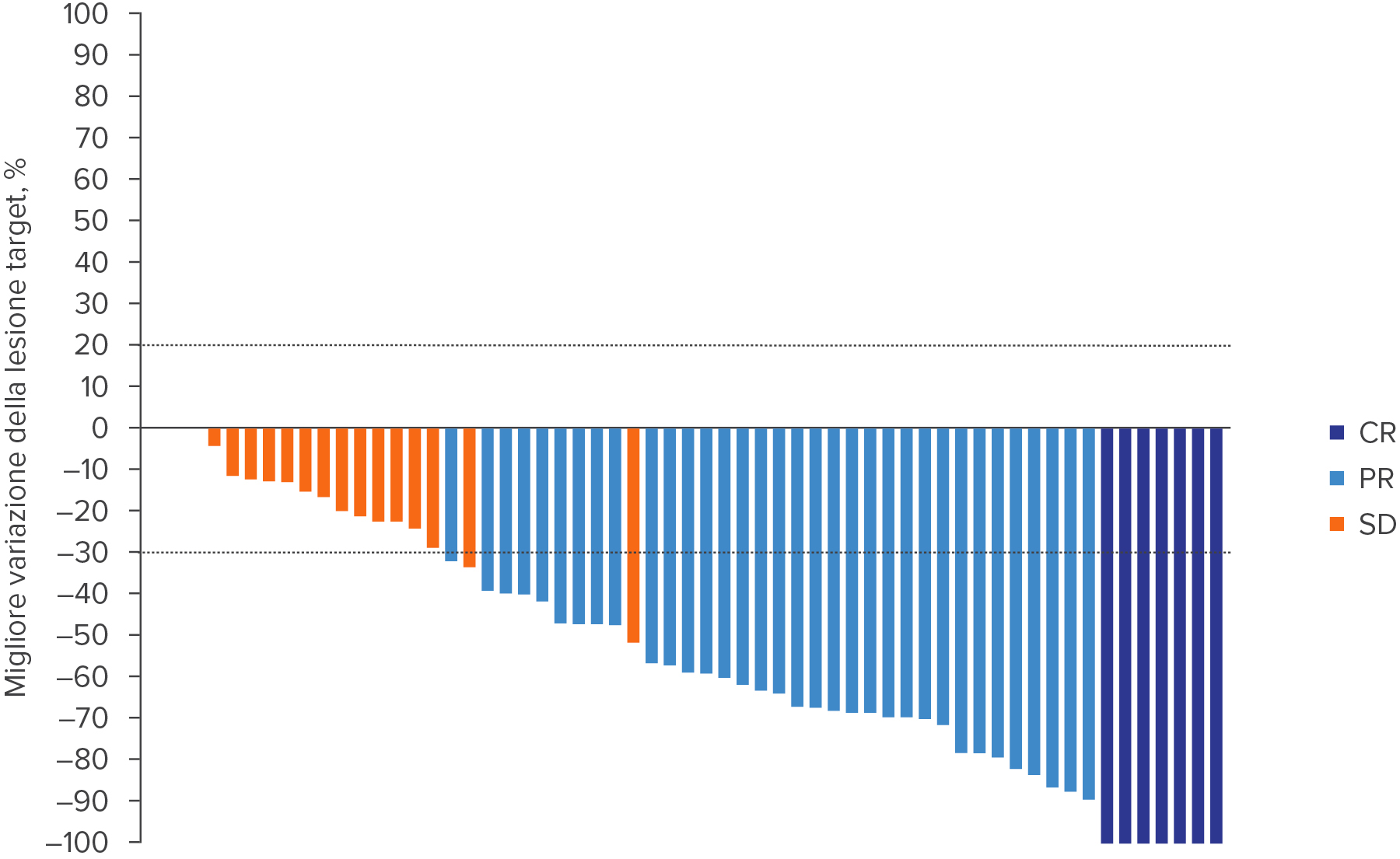
Adattato da Srinivasan R., et al., AACR 2024.4
Durata del trattamento con WELIREG® nelle lesioni target di RCC associate alla VHL, miglior tasso di risposta globale e stato della progressione della malattia4

Adattato da Srinivasan R., et al., AACR 2024.4
Stima di Kaplan-Meier della DOR e della PFS negli RCC associati alla VHL4,a

Grafici adattati da Srinivasan R., et al., AACR 2024.4
a. secondo RECIST v1.1 valutata da IRC.
+ indica che la risposta è ancora in corso.

Adattato da Srinivasan R., et al., AACR 2024.4
a. Dati insufficienti per la valutazione della risposta secondo RECIST v1.1.
+ indica che la risposta è ancora in corso.
Tempo mediano di follow-up dalla prima dose fino alla data di cut-off dei dati (3 aprile 2023): 49.9 mesi (intervallo: 48.2–58.1).
WELIREG® ha ridotto le dimensioni del tumore degli emangioblastomi associati alla VHL4,a

Adattato da Srinivasan R., et al., AACR 2024.4
a. Per 30 dei 50 pazienti erano disponibili dati valutabili dopo l’inizio dello studio con malattia misurabile; 4 pazienti hanno ottenuto una CR, tra cui 3 pazienti che, all’inizio dello studio, avevano solo una malattia non misurabile, e 3 pazienti hanno avuto una PD, tra cui 2 con sola malattia non misurabile all’inizio dello studio (non mostrati nel diagramma a cascata). Data di cut-off dei dati: 3 aprile 2023.4

Adattato da Srinivasan R., et al., AACR 2024.4
a. Dati insufficienti per la valutazione della risposta secondo RECIST v1.1.
b. I dati si riferiscono a tutte le lesioni pancreatiche (n = 61), comprese sia le lesioni pNET che quelle non pNET.
+ indica che la risposta è ancora in corso.
Tempo mediano di follow-up dalla prima dose fino alla data di cut-off dei dati (3 aprile 2023): 49.9 mesi (intervallo: 48.2–58.1).
WELIREG® ha ridotto le dimensioni del tumore dei pNET associati alla VHL4
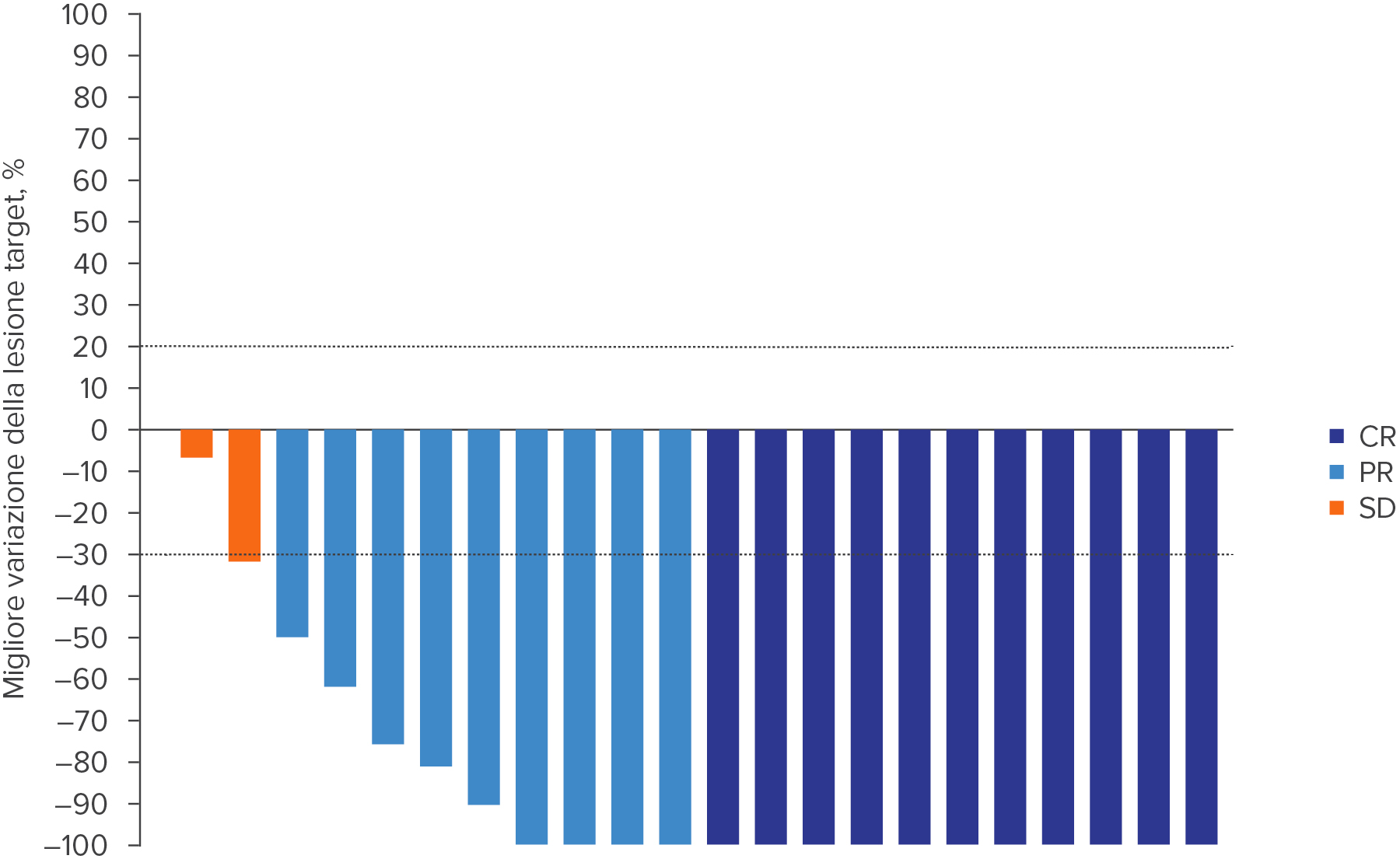
Adattato da Srinivasan R., et al., AACR 2024.4
WELIREG® ha portato a una riduzione degli interventi chirurgici correlati alla VHL.4
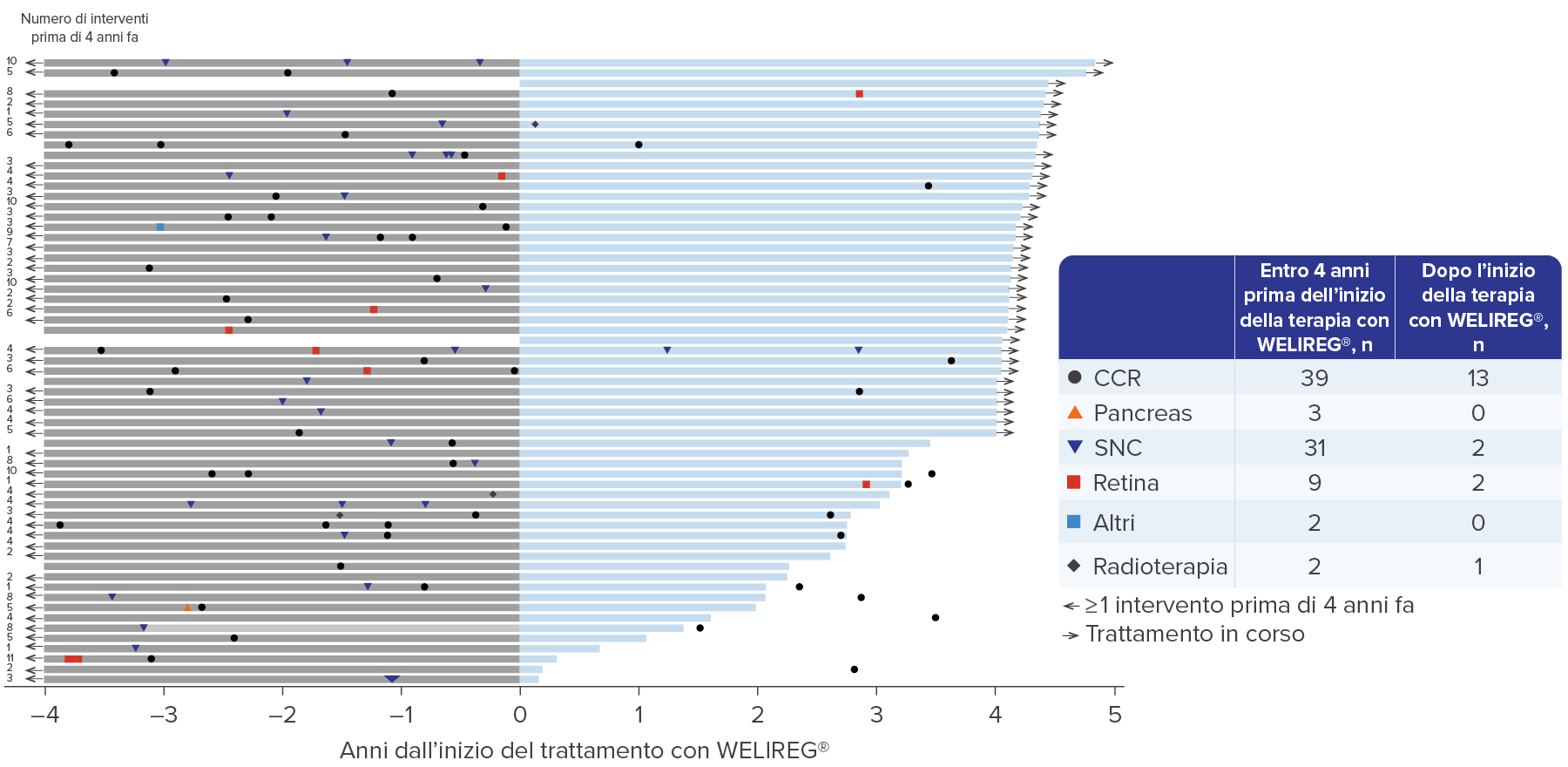
Adattato da Srinivasan R., et al., AACR 2024.4
I risultati a lungo termine dello studio LITESPARK-004 (analisi di follow-up a 49.9 (48.2-58.1) mesi) sostengono ulteriormente l’efficacia WELIREG® negli RCC, negli emangioblastomi dell’SNC e nei pNET associati alla VHL.4
Abbreviazioni:
CR: risposta completa (complete response); DOR: durata della risposta (duration of response); ECOG PS: Eastern Cooperative Oncology Group performance status; IRC: commissione indipendente di esperti (independent review committee); ORR: tasso di risposta globale (overall response rate); PD: malattia progressiva (progressive disease); pNET: tumore neuroendocrino del pancreas (pancreatic neuroendocrine tumor); PR: risposta parziale (partial response); RCC: carcinoma a cellule renali (renal cell carcinoma); RECIST v1.1: Response Evaluation Criteria In Solid Tumors v1.1; SD: malattia stabile (stable disease) ; SNC: sistema nervoso centrale; TTR: tempo fino alla risposta (time to response); TTS: tempo fino all’operazione (time to surgery); VHL: Von-Hippel-Lindau.
Riferimenti bibliografici:
- Informazione professionale di WELIREG® (belzutifan), www.swissmedicinfo.ch, ultima consultazione il 07.03.2025.
- Jonasch E, et al. Belzutifan for Renal Cell Carcinoma in von Hippel-Lindau Disease. N Engl J Med. 2021;385:2036 – 2046. DOI: 10.1056/NEJMoa2103425.
- Eisenhauer EA, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228 – 247.
- Srinivasan R, et al. Belzutifan, a Hypoxia-Inducible Factor-2α Inhibitor, for von Hippel-Lindau Disease–Associated Neoplasms: Long-Term Results of the Phase 2 LITESPARK-004 Study. Presented at the American Association for Cancer Research (AACR) Annual Meeting; San Diego, California; April 5 – 10, 2024.
▼ Questo medicamento è soggetto a monitoraggio addizionale. Per ulteriori informazioni, vedere l’informazione professionale di WELIREG® su www.swissmedicinfo.ch.
Prima della prescrizione, consultare l’informazione professionale completa pubblicata sul sito www.swissmedicinfo.ch.
