Les modèles mathématiques peuvent-ils prévoir des DDI et améliorer la gestion des TARs?
Article | 2018 Stader F. et. al.
Le fumarate de ténofovir disoproxil et l’emtricitabine (TDF/FTC) constituent souvent la base du traitement antirétroviral (TARV) dans la prise en charge et la prévention du VIH et de l’hépatite B.1 Une néphrotoxicité et une diminution de la densité minérale osseuse ont été décrits comme effets indésirables liés à la prise de TDF.2
La méta-analyse de Pilkington et al.1 porte sur l’actualisation d’une investigation systématique antérieure comparant les prodrogues ténofovir alafénamide (TAF) et TDF.3 L’objectif de la méta-analyse de Pilkington et al. était de réaliser un résumé actualisé de toutes les comparaisons existantes en matière d’efficacité et de sécurité entre TDF et TAF, avec et sans booster.1
Toutes les études incluses sont reprises dans le tableau 1.
La recherche bibliographique menée pour la méta-analyse initiale de Hill et al. a obtenu 253 ensembles de données. Les critères d’inclusion étaient les suivants: conception d’étude randomisée et contrôlée (RCT, randomized controlled trial) avec traitement reposant sur l’administration de TDF ou de TAF
Schéma de 24 semaines au minimum. Les études observationnelles et les études avec ajustement posologique étaient exclues. Après application de ces critères d’inclusion et d’exclusion, 11 RCT appropriées sur la comparaison de TDF et TAF ont pu être identifiées.3
Ces 11 études ont été complétées par trois autres études (ADVANCE, AMBER, DISCOVER) impliquant 6814 nouveaux patients avec 11 262 patients-années de suivi (patient-years of follow-up, PYFU). De nouvelles données de suivi associées à trois études incluses auparavant ont également été prises en compte.
Au total, 14 études rassemblant les données de 14 894 patients ont été incluses. Cela correspond à un total de 23 723 patients-années de suivi. 6743 patients ont reçu du TDF et 8151 patients du TAF. Au total, 6032 patients ont participé aux 8 études qui incluaient un booster, tandis que 8862 patients ont participé aux 6 études sans booster.
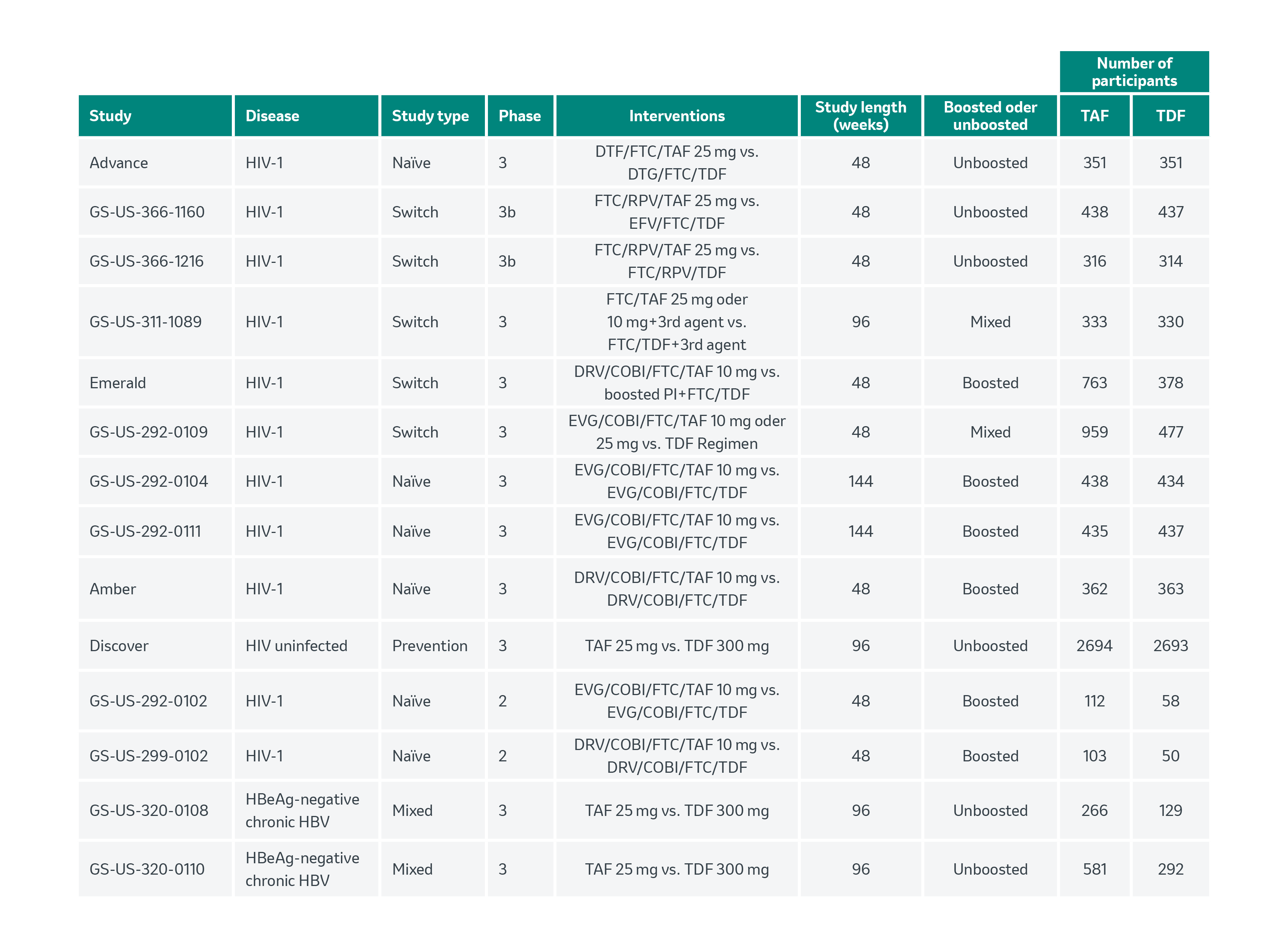
Tableau 1. Tableau récapitulatif des détails concernant toutes les études incluses dans la méta-analyse.
Des données concernant l’efficacité et le profil de sécurité ont été extraites des études incluses.
Les auteurs ont défini l’efficacité de la manière suivante: nombre de patients qui ont atteint une charge virale (ARN) du VIH inférieure à 50 copies/ml (log copies/ml). Efficacité des traitements par TDF et TAF
La comparaison a uniquement été effectuée auprès de personnes séropositives au VIH. Les autres infections virales, telles que l’hépatite, ont été exclues.
L’analyse du profil de sécurité a évalué le risque global d’événements indésirables en tenant compte de l’ensemble des événements indésirables de grade 1 à 4 (Gr1-4AE) et de grade 3 à 4 (Gr3-4AE), des événements indésirables graves (SAE), des résultats d’analyse anormaux de grade 3 ou 4 et des décès (toutes causes confondues). Les événements Gr3 + 4 AE ont été considérés comme graves ou susceptibles d’engager le pronostic vital.
L’analyse portait également sur les effets secondaires osseux et rénaux. L’atteinte osseuse a été mesurée sur la base d’interruptions d’études pour cause de toxicité osseuse et de fractures (en tant que marqueurs pertinents d’altérations de la densité minérale osseuse). Les «événements indésirables rénaux» (soit tous les événements indésirables signalés par les investigateurs principaux comme signes d’altération de la fonction rénale ou ayant un lien avec celle-ci) et les «interruptions d’étude en raison d’événements indésirables rénaux» ont été utilisés comme marqueurs de néphrotoxicité. Ils ont permis de calculer les taux d’incidence cumulatifs de tous les événements rénaux, de quelque nature que ce soit.
Le tableau 2 récapitule les résultats des études liés à l’efficacité et au profil de sécurité concernant le TAF vs le TDF dans des schémas avec et sans booster.
Contexte
Résultats en matière de sécurité
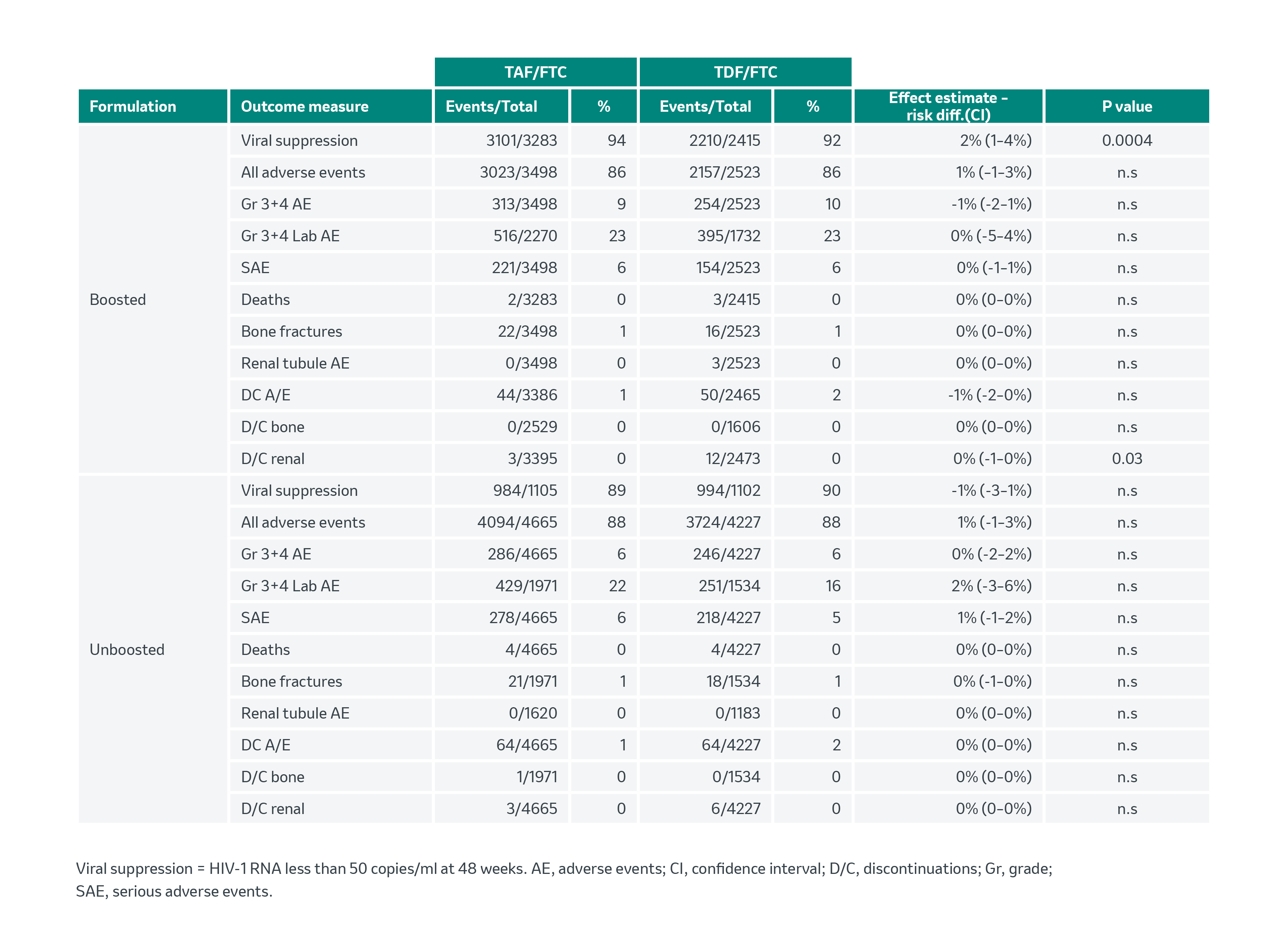
Efficacité:
Profils de sécurité:
Les résultats de cette méta-analyse sont conformes aux précédentes conclusions: l’efficacité et le profil de sécurité du TAF et du TDF sont semblables.3 Les seules différences significatives ont pu être observées sous TDF avec booster. L’étude ne prend toutefois en compte aucun critère d’évaluation de la sécurité plus global, tel que d’éventuels effets cardiovasculaires sous TAF vs TDF.
TDF: fumarate de ténofovir disoproxil, FTC: emtricitabine, TAF: ténofovir alafénamide, TARV: traitement antirétroviral, RCT: étude randomisée contrôlée (randomized controlled trial), PYFU: patients-années de suivi (patient-years of follow-up), Gr1-4AE: événements indésirables de grade 1-4, Gr3-4AE: événements indésirables de grade 3-4, SAE: événements indésirables graves.
1. Pilkington, V. et al. Tenofovir alafenamide vs. tenofovir disoproxil fumarate: an updated meta-analysis of 14 894 patients across 14 trials. AIDS Lond. Engl. 34, 2259–2268 (2020). 2. Swissmedic. Fachinformation Viread, Stand Oktober 2022. 3. Hill, A., Hughes, S. L., Gotham, D. & Pozniak, A. L. Tenofovir alafenamide versus tenofovir disoproxil fumarate: is there a true difference in efficacy and safety? J. Virus Erad. 4, 72–79 (2018).
Des copies des publications mentionnées ici peuvent être demandées à l’adresse dpoc.switzerland@msd.com.
Avant de prescrire, veuillez consulter l’information professionnelle complète publiée sur la page d’accueil de Swissmedic www.swissmedicinfo.ch.

Article | 2018 Stader F. et. al.
Review | 2019 Boyle A. et al.
Chaque année, des millions de personnes meurent de maladies infectieuses. Nous ne négligeons aucun effort pour sauver et améliorer des vies. Nos décennies de travail dans le domaine des maladies infectieuses ont permis de grandes avancées scientifiques.